
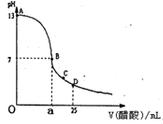
| A、c(OH-)一定大于c(CH3COO-) |
| B、c(OH-)一定小于c(CH3COO-) |
| C、c(OH-)一定等于c(CH3COO-) |
| D、上述三种情况都可能 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
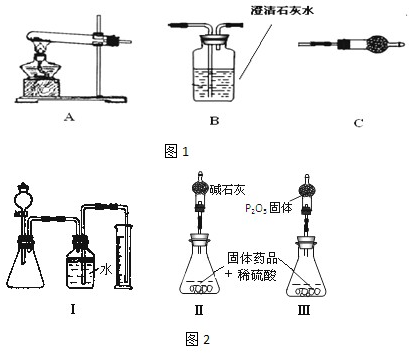
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | ||
| 第2步 | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种共价化合物 |
| B、在加热条件下不能产生有色气体 |
| C、它能与NaOH溶液反应 |
| D、该化合物中每个原子都能满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、AlCl3溶液中滴入NaHCO3溶液 |
| D、SO2通入Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时时俯视刻度线 |
| B、量筒量取5ml浓硫酸时俯视读数 |
| C、容量瓶中有蒸馏水 |
| D、溶解后未经冷却就转移到容量瓶进行定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①②④⑤ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com