
�ϳɰ����ع�ҵ�����������漰������ת����������ͼ��ʾ��
(1)��Ȼ���ڸ��¡�������������ˮ������Ӧ����H2��CO�Ļ�ѧ����ʽΪ___________________________________��
(2)�ںϳɰ������У������ɵİ�����ʱ�ӷ�Ӧ��������з�����������û�ѧƽ���֪ʶ�����������Ƿ������ڰ��ĺϳɣ�˵�����ɣ�___________��
(3)��ͼΪ�ϳɰ���Ӧ�ڲ�ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£���ʼʱ�����������������Ϊ1��3ʱ��ƽ�������а������������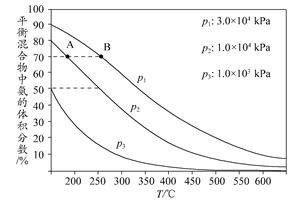
�����ֱ���vA(NH3)��vB(NH3)��ʾ�ӷ�Ӧ��ʼ��ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���vA(NH3)________vB(NH3)(�>������<������)��
������ͬ�¶��£���ѹǿ��p1��Ϊp3ʱ���ϳɰ���Ӧ�Ļ�ѧƽ�ⳣ��________(��������С�����䡱)��
����250��C��1.0��104kPa�£�H2��ת����Ϊ________%(����������С�����1λ)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ��ˮ�г�����һ������Cr2O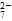 ��CrO
��CrO �����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֡�
�����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֡�
����1����ԭ������
�÷��Ĺ�������Ϊ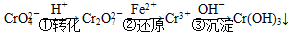
���еڢٲ�����ƽ�⣺
2CrO (��ɫ)��2H��
(��ɫ)��2H�� Cr2O
Cr2O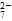 (��ɫ)��H2O
(��ɫ)��H2O
(1)��ƽ����ϵ�� pH �� 2������Һ��________ɫ��
(2)��˵���ڢٲ���Ӧ��ƽ��״̬����________��
a��Cr2O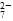 ��CrO
��CrO ��Ũ����ͬ
��Ũ����ͬ
b��2v(Cr2O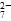 )��v(CrO
)��v(CrO )
)
c����Һ����ɫ����
(3)�ڢڲ��У���ԭ 1 mol Cr2O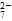 ���ӣ���Ҫ______mol��FeSO4��7H2O��
���ӣ���Ҫ______mol��FeSO4��7H2O��
(4)�ڢ۲����ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ�⣺
Cr(OH)3(s)  Cr3��(aq)��3OH��(aq)
Cr3��(aq)��3OH��(aq)
�����£�Cr(OH)3���ܶȻ�Ksp��c(Cr3��)��c3(OH��)��10��32��Ҫʹ c(Cr3��)����10��5mol/L����Һ��pHӦ����________��
����2����ⷨ
�÷��� Fe ���缫��⺬Cr2O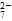 �����Է�ˮ�����ŵ��Ľ��У�������������Һ pH ���ߣ����� Cr(OH)3������
�����Է�ˮ�����ŵ��Ľ��У�������������Һ pH ���ߣ����� Cr(OH)3������
(5)��Fe���缫��ԭ��Ϊ______________________________________
(6)������������Һ pH ���ߵ�ԭ����(�õ缫��Ӧ����)________________����Һ��ͬʱ���ɵij�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ʵ�����A��B��C��D�������ʻ�Ϸ���V L�ܱ�������,�������·�Ӧ:aA+bB cC(s)+dD,����Ӧ���е���t minʱ,���A������n mol,B������n/2 mol,C������3n/2 mol,D������n mol����ʱ��Ӧ�ﵽƽ�⡣
cC(s)+dD,����Ӧ���е���t minʱ,���A������n mol,B������n/2 mol,C������3n/2 mol,D������n mol����ʱ��Ӧ�ﵽƽ�⡣
(1)�û�ѧ����ʽ��,�����ʵĻ�ѧ�������ֱ�Ϊ:a=��������,b=��������,c=��������,d=����������
(2)��B��Ũ�ȱ仯��ʾ�ĸû�ѧ��Ӧ������Ϊv(B)=����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij̽����ѧϰС������ͬ������п����ͬŨ�ȵ�������ϡ���ᷴӦ�õ�ʵ���������±���ʾ��
| ʵ���� | п��״̬ | ��Ӧ�¶�/�� | �ռ�100 mL���� ����ʱ��/s |
| �� | ��Ƭ | 15 | 200 |
| �� | ��Ƭ | 25 | 90 |
| �� | ��ĩ | 25 | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧѧ���еĻ�ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ����
��ش��������⣺ ��1����ҵ�ϲ�ȡCO��H2Ϊԭ�Ϻϳ��Ҵ����仯ѧ��Ӧ����ʽΪ��2CO��g����4H2��g��??
��1����ҵ�ϲ�ȡCO��H2Ϊԭ�Ϻϳ��Ҵ����仯ѧ��Ӧ����ʽΪ��2CO��g����4H2��g��??
CH3CH2OH��g����H2O��g������д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________��
��2�������£�Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��200 ��ʱ����a mol H2(g)��b mol I2(g)���뵽���ΪV L���ܱ������У�������Ӧ��I2(g)��H2(g)??2HI(g)��
(1)��Ӧ�տ�ʼʱ������c(H2)��________��c(I2)��________����c(HI)��________�����Ի�ѧ��Ӧ����________����________��С(Ϊ��)(�v������v����)��
(2)���ŷ�Ӧ�Ľ��У���Ӧ������и����Ũ�ȵı仯����Ϊc(H2)________��c(I2)________����c(HI)________���Ӷ���ѧ��Ӧ����v��________����v��________(���������С�����䡱)��
(3)����Ӧ���е�v����v��________ʱ���˿��淴Ӧ�ʹﵽ������ȣ������������������ʱ��������и���ֵ����ʵ��������ʵ���Ũ�ȡ����������������������Ӧ���ת���ʺ�������IJ��ʼ���ϵ����ѹǿ(�����ֵķ�ѹ)����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��N2��g����3H2��g��  2NH3��g������H����94.4 kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
2NH3��g������H����94.4 kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��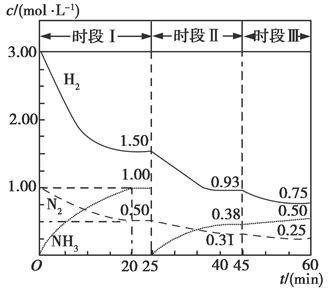
����1 L�����з�����Ӧ��ǰ20 min�ڣ�v��NH3����________���ų�������Ϊ________��
��25 minʱ��ȡ�Ĵ�ʩ��_______________________��
��ʱ�������·�Ӧ��ƽ�ⳣ������ʽΪ________���þ������ݱ�ʾ����
��2���糧�������뵪������Ӧ�٣�4NH3��g����6NO��g�� 5N2��g����6H2O��g��������Ӧ�ڣ�2NH3��g����8NO ��g��
5N2��g����6H2O��g��������Ӧ�ڣ�2NH3��g����8NO ��g��  5N2O��g����3H2O��g������H��0�����ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ����400��600 Kʱ��ƽ��������N2�������¶ȵı仯������________���������ֱ仯���ɵ�ԭ����________���δ������һ��ԭ��
5N2O��g����3H2O��g������H��0�����ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ����400��600 Kʱ��ƽ��������N2�������¶ȵı仯������________���������ֱ仯���ɵ�ԭ����________���δ������һ��ԭ��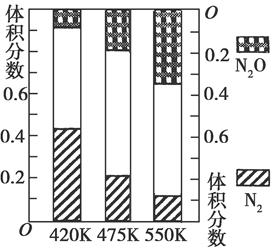
��3��ֱ�ӹ���ʽȼ�ϵ������NaOH��ҺΪ����ʵġ���ط�ӦΪ4NH3��3O2=2N2��6H2O�����缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij���Թ�ҵ��ˮ�к���K2Cr2O7�������£�����(H2C2O4)�ܽ����е�Cr2O72��ת��ΪCr3����ij�������о����֣�����������[Al2Fe(SO4)4��24H2O]���ɶԸ÷�Ӧ������á�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
(1)��25���£����ƹ���ǿ�ȡ���ˮ��Ʒ��ʼŨ�Ⱥʹ���������ͬ�����ڲ�ͬ�ij�ʼpH��һ��Ũ�Ȳ�����Һ���������Ա�ʵ�飬�������ʵ����Ʊ�(���в�Ҫ���ո�)��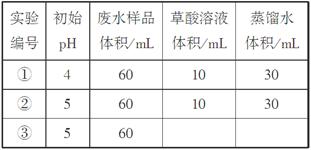
���ʵ��ٺ͢���Һ�е�Cr2O72��Ũ����ʱ��仯��ϵ��ͼ��ʾ��
(2)������Ӧ����ᱻ����Ϊ______________(�ѧʽ)��
(3)ʵ��ٺ͢ڵĽ������________��ʵ�����0��t1ʱ��η�Ӧ����v(Cr3��)��________mol��L��1��min��1(�ô���ʽ��ʾ)��
(4)�ÿ������������[Al2Fe(SO4)4��24H2O]��������õijɷ�������¼��裬������ɼ�����ͼ�������
����һ��Fe2��������ã�
�������________��
�������� ________��
����
(5)�������ʵ����֤��������һ������±������ݡ�[��������ʵ���ṩ���Լ��⣬�ɹ�ѡ���ҩƷ��K2SO4��FeSO4��K2SO4��Al2(SO4)3��24H2O��Al2(SO4)3�ȡ���Һ��Cr2O72����Ũ�ȿ��������ⶨ]
| ʵ�鷽�� (��Ҫ��д�����������) | Ԥ��ʵ�����ͽ��� |
| | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪CO2��g����H2��g�� CO��g����H2O��g����ƽ�ⳣ�����¶ȱ仯���±���
CO��g����H2O��g����ƽ�ⳣ�����¶ȱ仯���±���
| t/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| | A | B | C | D | E |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 2 | 1 |
 CO��g����H2O��g�����ڸ������ڸ����ʵ�Ũ�ȱ仯���£�
CO��g����H2O��g�����ڸ������ڸ����ʵ�Ũ�ȱ仯���£�| ʱ�� /min | CO2 ��mol��L��1�� | H2 ��mol��L��1�� | CO ��mol��L��1�� | H2O ��mol��L��1�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com