
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
分析 A.ICl中Cl元素的非金属性强;
B.将①+②可得到H2(g)+2ICl(s)=I2(s)+2HCl(g);
C.慢反应决定反应速率;
D.将①+②可得到H2(g)+2ICl(s)=I2(s)+2HCl(g),1molICl(s)被H2(g)完全还原为I2(s)和HCl(g)时,放出109kJ的热量,以此来解答.
解答 解:A.ICl中Cl元素的非金属性强,则Cl为-1价,I为+1价,故A错误;
B.将①+②可得到H2(g)+2ICl(s)=I2(s)+2HCl(g),可知HI是反应的中间产物,故B正确;
C.慢反应决定反应速率,则总反应速率的快慢主要由反应①决定,故C错误;
D.将①+②可得到H2(g)+2ICl(s)=I2(s)+2HCl(g),1molICl(s)被H2(g)完全还原为I2(s)和HCl(g)时,放出109kJ的热量,则$\frac{1}{2}$H2(g)+ICl(s)=$\frac{1}{2}$I2(s)+HCl(g)△H=-109kJ•mol-1,故D错误;
故选B.
点评 本题考查氧化还原反应及热化学反应、反应速率等,为高频考点,把握热化学反应方程式的书写、反应速率的影响因素等为解答的关键,侧重分析与应用能力考查,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
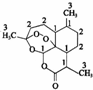 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 离子反应 | C. | 置换反应 | D. | 蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:
硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐增大,而ⅦA元素的电负性从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其离子核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
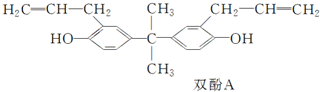
| A. | 双酚A分子中所有原子不可能在一个平面上 | |
| B. | 双酚A分子式为C21H24O2 | |
| C. | 双酚A可以发生聚合反应 | |
| D. | 1 mol双酚A最多可与4 mol浓溴水发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com