
分析 (1)I.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
Ⅱ.左下角数字为质子数,左上角数字为质量数,中子数=质量数=质子数;
Ⅲ.N元素化合价有-3、+1、+2、+3、+4、+5;
Ⅳ.X2Y2型化合物的是Na2O2,X3Y2型化合物的是Mg3N2;
(2)An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则核电荷数B>A>C>D,核电荷数越大,离子半径越小.
解答 解:(1)I.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:②>③>④>①,故答案为:②>③>④>①;
Ⅱ.:①${\;}_{8}^{18}$O中质子数为8,中子数为18-8=10,质子数小于中子数,②${\;}_{11}^{23}$Na中质子数为11,中子数为23-11=12,质子数小于中子数,③${\;}_{12}^{24}$Mg中质子数为,12,中子数为24-12=12,质子数等于中子数,④${\;}_{7}^{14}$N中质子数为7,中子数为14-7=7,质子数等于中子数,故答案为:①②;
Ⅲ.N元素化合价有-3、0、+1、+2、+3、+4、+5,化合价最多,故答案为:④;
Ⅳ.X2Y2型化合物的是Na2O2,X3Y2型化合物的是Mg3N2,故答案为:①②;③④;
(2)An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则核电荷数B>A>C>D,即原子序数B>A>C>D,核电荷数越大,离子半径越小,故离子半径:D>C>A>B,
故答案为:D>C>A>B;B>A>C>D.
点评 本题属于拼合型题目,涉及微粒半径比较、原子构成、元素化合价等,比较基础.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
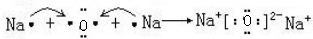 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: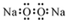 | B. | 中子数为 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫离子的结构示意图: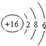 | D. | HCN的结构式:H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com