
 溴主要以Br-形式存在于海水中,海水呈弱碱性.工业上制备的Br2的操作步骤为:
溴主要以Br-形式存在于海水中,海水呈弱碱性.工业上制备的Br2的操作步骤为:分析 (1)Cl2氧化Br-生成溴单质,通风橱进行防止溴中毒、溴与碱反应;
(2)溴易挥发;
(3)发生氧化还原反应生成硫酸钠、溴单质、水;盐酸能被溴酸钠氧化,并结合溴挥发来分析;
(4)利用NaBr溶液与Cl2反应,然后分液可除去Cl2.
解答 解:(1)Cl2氧化Br-生成溴单质,则应在通风橱中酸性条件下进行,防止溴中毒及生成的溴与碱发生反应,
故答案为:通风橱中酸性;溴中毒及生成的溴与碱发生反应;
(2)因溴的沸点较低,易挥发,Br2可用热空气吹出,
故答案为:溴的沸点较低,易挥发;
(3)发生氧化还原反应生成硫酸钠、溴单质、水,该反应为3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O,盐酸能被溴酸钠氧化,则不能利用盐酸酸化,且溴挥发,对大气造成污染,则有时运输到目的地后再酸化,
故答案为:3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O;用盐酸酸化,则盐酸被NaBrO3氧化;
(4)利用NaBr溶液与Cl2反应,然后分液可除去Cl2,只有c符合,其它选项会引入新的杂质,故答案为:c.
点评 本题考查工业制Br2,考查分析问题解决问题的能力,注意溴易挥发及发生的氧化还原反应为解答的关键,注重环境保护和实验安全.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.4mol/L | C. | 0.3mol/L | D. | 0.15mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;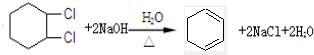 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -69.4 kJ/mol | B. | -45.2kJ/mol | C. | +69.4 kJ/mol | D. | +45.2 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中导电粒子的数目增加,导电性增强 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 理由 | 结论 |
| A | 相同物质的量浓度溶液的pH: Ca(ClO)2>CH3COONa | 酸性:CH3COOH>HClO |
| B | 同体积相同pH的盐酸和醋酸与相同的锌 反应的速率:醋酸>盐酸 | 酸性:HCl>CH3COOH |
| C | 相同条件下的沸点: H2O>NH3 | 非金属性:O>N |
| D | 相同物质的量得到电子的数目: 稀硝酸>浓硝酸 | 氧化性:稀硝酸>浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com