
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是( )
A.使酚酞溶液变红,说明溶液显酸性
B.溶液呈现黄绿色,且有刺激性气味,说明有 Cl2 存在
C.先加入HCl溶液酸化,再加入AgNO3溶液产生白色沉淀,说明有 Cl-存在
D.新制氯水放置数天后酸性将减弱
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
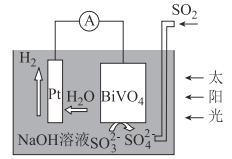
A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4,含 Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.由于Cu2+存在,IV中M的分解速率比I快
B.其它条件相同时,水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比II
D.在0~20 min内,I中M的平均分解速率为0.015mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:

请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)简单鉴别Fe(OH)3胶体和FeCl3溶液的方法是_______________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请用双线桥表示出电子转移的方向和数目_____________________
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____;
②验证该溶液中含有Fe2+,正确的实验方法是_______(用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
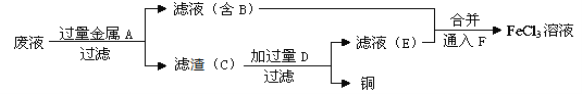
①滤渣C的主要成分的化学式为_______、_______。
②加过量D发生反应的离子方程式为__________________________________。
③通入F发生反应的化学方程式为 ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O。若产生的氯气在标况下的体积为2.24L,试计算:
MnCl2 +Cl2↑+2H2O。若产生的氯气在标况下的体积为2.24L,试计算:
(1)参加反应的MnO2的质量____________
(2)参加反应的HCl的物质的量___________
(3)反应中被氧化的HCl的物质的量____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①ClO2的浓度较大时易分解,实验室用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I+8H+2Cl+5I2+4H2O。
③![]()

请回答:
(1) 仪器b在装置中的作用是________;比较仪器c和d,实验中c的优点是________。
(2) 制备装置甲中需改进的一项措施是________。
(3) 反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:________;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________。
(4) 下列有关说法正确的是________。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5ClO=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5) 自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100.0 mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000 mol·L1 Na2S2O3标准溶液滴定碘单质(I2+2S2O![]() =2I+S4O62—),达到滴定终点时用去15.00 mL Na2S2O3标准溶液,测得该水样中ClO2的含量为________mg·L1。
=2I+S4O62—),达到滴定终点时用去15.00 mL Na2S2O3标准溶液,测得该水样中ClO2的含量为________mg·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
A.c(I-)=2a mol·L—1
B.v (I-)=2v(AsO43-)
C.c(AsO43-)/c(I-)不再变化
D.溶液的pH不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com