
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )| A、元素Q的非金属性比R的强 |
| B、离子半径的大小顺序:r(Tm+)>r(Wn-) |
| C、元素Q的氧化物均为酸性氧化物 |
| D、元素T与元素R的最高正价之和等于8 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
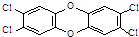 1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图.下列说法中不正确的是
1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图.下列说法中不正确的是| A、它的分子式为C12H4O2Cl4 |
| B、它不能发生加成反应 |
| C、它的一溴取代物有一种 |
| D、此分子中共平面的原子最多有22个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应活化能等于80kJ?mol-1 |
| B、逆反应活化能一定大于80kJ?mol-1 |
| C、逆反应活化能不大于80kJ?mol-1 |
| D、正反应活化能比逆反应活化能小80kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO是弱酸,所以NaClO是弱电解质 |
| B、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| C、放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| D、自来水水阀生锈主要是化学腐蚀所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol硝基(-NO2)与NA个二氧化氮气体分子所含电子数相等 |
| B、1mol氢氧根离子(OH-)与NA个羟基(-OH)所含电子数相等 |
| C、在相同温度下,pH=1且体积为1L的硫酸溶液所含氢离子数与pH=13且体积为1L的氢氧化钠溶液所含氢氧根离子数一定均为0.1NA |
| D、在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,每生成1molO2该反应共转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑤ | B、①④⑥ |
| C、①②④⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
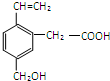 ,下列对其性质的叙述中不正确的是( )
,下列对其性质的叙述中不正确的是( )| A、不能与钠反应放出氢气 |
| B、能与溴水发生加成反应 |
| C、能发生加聚反应 |
| D、不能与新制的Cu(OH)2悬浊液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴阳离子排列方式相同 |
| B、晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子 |
| C、离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键 |
D、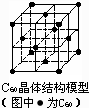 C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
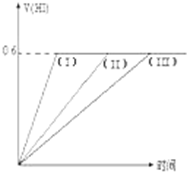 在一定温度下发生反应:I2(g)+H2(g)?2HI(g);并达平衡.HI的体积分数V(HI)%随时间变化如图曲线(II)所示.若改变反应条件,在甲条件下的变化如曲线(I)所示.在乙条件下的变化如曲线(III)所示.则甲条件、乙条件分别是( )
在一定温度下发生反应:I2(g)+H2(g)?2HI(g);并达平衡.HI的体积分数V(HI)%随时间变化如图曲线(II)所示.若改变反应条件,在甲条件下的变化如曲线(I)所示.在乙条件下的变化如曲线(III)所示.则甲条件、乙条件分别是( ) | A、①⑤,③ | B、②⑤,④ |
| C、③⑤,② | D、③⑤,④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com