
(13分)表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需______g10%(密度为1.00g·cm-3)的NaOH溶液,需加______mL水(密度为1.00g·cm-3)进行稀释。
②量取:用_______mL量筒(可供选择的量筒规格有:5mL、10mL、25mL、50mL,下同)量取10%的NaOH溶液,量取时视线要跟量筒内液体_______相切,然后倒入烧杯里,用______mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述G操作中目光仰视,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。
(3)实验室用NaOH固体配制1mol/L的NaOH溶液和用98%(密度为1.84g·cm-3)的浓硫酸配制1mol/L的H2SO4溶液各100mL。
①配制1mol/L的NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为_______(填代号,下同)。
A.4.0g B.小于4.0g C.大于4.0g
②配制1mol/L的H2SO4溶液,在烧杯中稀释浓硫酸的正确操作是: 。
13分)(1) ① 5.5g (1分) ; 22ml (1分) ; ② 10ml (1分) ;凹液面的最低点 (1分) ; 25ml (1分) ;(2) ① 16.3 (1分) ; ② ADECBHGF (1分) ; ③ 偏高(1分) ;偏高(1分) ;偏低(1分) ;偏低(1分) ;(3)① C (1分) ;② 在烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁缓缓到入烧杯中,边倒边用玻璃杯搅拌。(1分)
解析试题分析:(1)①由ω1m1=ω2m2得m2=ω1m1/ω2=27.5g2%/10%=5.5g,需加水27.5g-5.5g=22g。
②量取液体应一次量取,选用量程最小的量筒,故用10mL量筒量取5.5ml 10%的NaOH溶液,量取时视线要跟量筒内液体凹液面的最低点相切,然后倒入烧杯里,用25mL量筒量取22ml蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
①硫酸的物质的量3mol/L×0.1L=0.3mol,硫酸的质量0.3mol×98g/mol=29.4g,需浓硫酸的质量29.4g/98%=30g,需要量取浓硫酸30g/1.84 g·cm-3=16.3mL(保留一位小数)。
②配制操作顺序是:A.检查容量瓶是否漏水D.计算并量取E.稀释C.转移溶液 B.洗涤并重复H.加蒸馏水G.定容F.振荡,摇匀
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,冷却后溶液的体积将减小,所配溶液的浓度将偏高;如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,溶质硫酸偏大,所配溶液的浓度将偏高;如果上述G操作中目光仰视,溶液体积偏大,所配溶液的浓度将偏低;如果上述D操作中目光俯视,所取硫酸的物质的量偏小,所配溶液的浓度将偏低。
(3)①用托盘天平称取NaOH固体时,应在烧杯或称量瓶中进行称量,天平读数为大于4.0g ,答案选C。
②在烧杯中稀释浓硫酸时会放热,正确操作是在烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁缓缓到入烧杯中,边倒边用玻璃杯搅拌。
考点:溶液的组成、质量分数、物质的量浓度


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.化石燃料燃烧产生大量CO2,会导致温室效应 |
| B.血液透析利用了胶体的性质 |
| C.自来水可用氯气来杀菌消毒,说明氯气无毒 |
| D.采用原煤脱硫技术,可减少燃煤燃时产生的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(21分)实验室欲配制80mL,1.5 mol/L的NaHCO3溶液,试回答:
(1)该实验必须使用的玻璃仪有 ;
(2)配置该溶液时应称取NaHCO3的质量为_____________________;(3)下列操作对上述所配溶液物质的量浓度的影响(填写无影响、偏高或偏低)
A.配制过程中未洗涤烧杯和玻璃棒;
B.容量瓶使用之前未烘干,有少量蒸馏水;
C.定容时俯视容量瓶的刻度线;
D.将所配溶液从容量瓶转移到试剂瓶时,有少量液体溅出;__________
写出下列反应的离子方程式:
A.向NaHCO3溶液中滴加盐酸
B.向Ba(OH)2溶液中滴加少量NaHCO3溶液
C.向氨水中滴加MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
| A.托盘天平 |
| B.容量瓶 |
| C.酸式滴定管 |
| D.量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)实验题
下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制200 mL 1.0 mol/L的稀硫酸。可供选用的仪器有: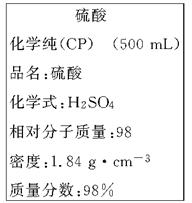
①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制上述稀硫酸时,还缺少的仪器有________________________(写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为___________________________
(3)配制200 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL(计算结果保留小数点后1位),量取硫酸时应选用_______规格的量筒;
| A.10 mL | B.50 mL |
| C.100 mL | D.200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
17分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。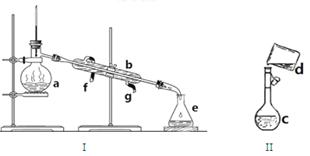
(1)写出下列仪器的名称:a. 、b. 、c.
(2)仪器a~e中,使用前必须检查是否漏水的有 (填序号)
(3)若用装置I分离水和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 口通入, 口流出(填f或g)
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是
②除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:
③根据计算得知,所需NaOH的质量为 g
④配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称一定质量的NaOH固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.恢复到室温后将NaOH溶液沿玻璃棒注入500mL的容量瓶中(有少量溶液因操作不慎溅出瓶外) |
| D.将容量瓶盖紧,振荡、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
8分)用18.4mol·L-1密度为1.84g·mL-1的浓硫酸,配制100mL浓度为1mol·L-1的稀硫酸,其操作步骤如下:
| A.用量筒量取一定体积的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都注入容量瓶里。 |
| C.将稀释后的硫酸小心地用玻璃棒引流入容量瓶。 |
| D.继续向容量瓶中加蒸馏水,液面至刻度线下1cm~2cm。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(每空1分,共8分)实验室需要配制0.1 mol/L CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、_______ _、________以及等质量的两片滤纸。
(2)计算,应选择下列正确________
| A.需要CuSO4固体8.0g | B.需要CuSO4·5H2O晶体12.0 g |
| C.需要CuSO4·5H2O晶体12.5 g | D.需要CuSO4固体7.7 g |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关铁及其化合物的说法中不正确的是
| A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 |
| B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 |
| C.工业上可用铁质容器储存、运输浓硝酸、浓硫酸 |
| D.氯化铁溶液有较强氧化性,故可用作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com