
| n |
| 2 |
| 3n |
| 2 |


科目:高中化学 来源: 题型:
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、盐酸与澄清石灰水反应:H++OH-═H2O |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | HA的物质的量浓度(mol?L-1) | NaOH的物质的量浓度(mol?L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
| CH3COOH | H2CO3 | H2S |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
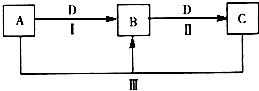 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
 容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A、当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B、在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C、在t min时测得c(N2)Ⅲ=1 mol/L,若再向Ⅲ中充入1.5 mol N2和1 mol NH3,H2的转化率不变 |
| D、三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、腌制腊类物质添加大量亚硝酸钠 |
| B、金针菇可用福尔马林浸泡来达到保鲜的目的 |
| C、用NaHCO3发酵面包 |
| D、竹笋用二氧化硫气体漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com