

分析 (1)根据氧化还原反应中得失电子守恒及原子个数守恒规律配平方程式,;
(2)依据氯化氢在反应中氯元素化合价变化判断盐酸性质;依据方程式:K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O,生成3mol氯气,转移6mol电子,氧化剂物质的量为1mol,还原剂物质的量为6mol,据此解答;
(3)①熟悉仪器的形状说出其名称;浓盐酸易挥发制备的氯气中含有氯化氢,依据氯气、氯化氢的水溶性选择合适的除杂剂;
②氯气的氧化性强于碘,碘易溶于四氯化碳;
③二氧化硫与氯气、水反应生成盐酸和硫酸,硫酸与氯化钡反应生成硫酸钡沉淀;
④二氧化硫的漂白性具有可逆性;次氯酸的漂白性不具有可逆性;
解答 解:(1)Cr元素化合价变化为:K2Cr2O7→CrCl3,化合价由+6→+3价,一个原子得3个电子,两个原子得6个电子;Cl元素的化合价变化为:HCl→Cl2,化合价由-1价→0价,一个原子失去一个电子,所以其最小公倍数为6,K2Cr2O7的计量数为1,作还原剂的 HCl的计量数为6,再根据原子守恒判断其它分子的计量数,根据元素守恒,生成物中的未知物为水.所以该方程式为:K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O,用双线桥表示为: ;
;
故答案为: ;
;
(2)反应中氯化氢中氯元素部分化合价升高,表现为还原性,部分化合价不变表现为酸性,依据方程式:K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O,生成3mol氯气,转移6mol电子,氧化剂物质的量为1mol,还原剂物质的量为6mol,则转移0.3mol电子,则氧化剂与还原剂的物质的量为1:6,生成氯气0.15mol,标况下体积V=22.4L/mol×0.15mol=3.36L;
故答案为:酸性和还原性;1:6;3.36L;
(3)①图中仪器a为分液漏斗;浓盐酸易挥发制备的氯气中含有氯化氢,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,用饱和食盐水可以除去氯气中的氯化氢;
故答案为:分液漏斗;除去氯气中的氯化氢;
②氯气的氧化性强于碘,氯气与碘化钾反应生成单质碘,碘易溶于四氯化碳,四氯化碳密度大与水,与水互不相溶,所以看到现象:溶液分层,下层为紫红色;
故答案为:溶液分层,下层为紫红色;
③二氧化硫与氯气、水反应生成盐酸和硫酸,离子方程式:SO2+Cl2+2H2O═4H++2Cl-+SO42-;硫酸与氯化钡反应生成硫酸钡沉淀,离子方程式:SO42-+Ba2+=BaSO4↓;
故答案为:BaSO4;SO2+Cl2+2H2O═4H++2Cl-+SO42-;SO42-+Ba2+=BaSO4↓;
④二氧化硫能够与有色物质化合生成不稳定的无色物质,受热不稳定的无色物质分解生成有色物质,所以二氧化硫的漂白性具有可逆性,F中褪色的品红溶液加热恢复颜色;氯气与水反应生成的次氯酸具有强的氧化性,能够氧化有色物质生成稳定的无色物质,褪色的品红溶液加热不会恢复颜色;
故答案为:无明显现象;恢复颜色.
点评 本题以氯气、二氧化硫的制备为载体,考查了氧化还原反应方程式的书写、氯气的制备、提纯和性质的检验、离子方程式的书写,明确制备原理和物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C=C | C≡C |
| 键长(nm) | 0.154 | 0.134 | 0.120 |
| 键能(kJ/mol) | 347 | 612 | 838 |
| A. | 0.154 nm>苯中碳碳键键长>0.134nm | |
| B. | C=O键键能>C-O键键能 | |
| C. | 乙烯的沸点高于乙烷 | |
| D. | 烯烃比炔烃更易与溴加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 13 | C. | 7 | D. | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素A: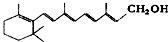 它是一种难溶于水的醇 它是一种难溶于水的醇 | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2 | |
| D. | 金属材料都是导体,非金属材料不都是绝缘体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
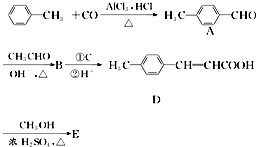
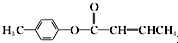 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为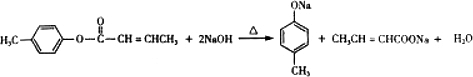 .
.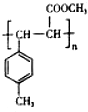 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、烧碱、氯酸钾、过氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | PM2.5指大气中直径接近于2.5×10-6 m的颗粒物,PM2.5在空气中形成胶体 | |
| C. | 氯气的水溶液能导电,因此氯气属于电解质 | |
| D. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com