
分析 无色溶液中不会存在有色的Cu2+;生成的沉淀加入稀硝酸后部分溶解,则沉淀为BaSO4和BaCO3的混合物,原溶液中含有SO42-、CO32-,根据离子共存可知溶液中不会存在Ca2+;向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀为氯化银,由于(1)中加入氯化钡后引进了氯离子,则无法判断原溶液中是否含有氯离子;最后根据溶液为电中性可知一定含有K+,据此进行解答.
解答 解:无色透明的溶液中不可能存在Cu2+,
滴加氯化钡溶液,有白色沉淀产生,生成的沉淀可能为BaSO4或BaCO3,其中BaCO3可溶于稀硝酸,将沉淀滤出,产生的沉淀可部分溶于稀硝酸,说明含有SO42-、CO32-离子,则一定不含Ca2+离子,根据溶液电中性原则,一定含有K+离子;
向滤液中加入硝酸银溶液,有白色沉淀生成,可能为Ag2SO4、Ag2CO3或AgCl沉淀,不能确定是否含有Cl-离子,
根据分析可知,溶液中一定含有的离子为:K+、SO42-、CO32-;一定不含的离子为:Cu2+、Ca2+;可能含有的离子为:Cl-;
步骤(2)中碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳气体和水,反应的离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:K+、SO42-、CO32-;Cu2+、Ca2+;Cl-;BaCO3+2H+=Ba2++H2O+CO2↑.
点评 本题考查了离子检验,题目难度中等,明确常见离子的性质及检验方法为解答关键,根据溶液电中性判断钾离子的存在为易错点,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
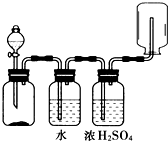
| A. | NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑ | B. | 二氧化锰和浓盐酸生成氯气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 锌和盐酸生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑥⑧ | C. | ⑦⑧⑨ | D. | ⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| C. | 气态氢化物的稳定性:Z<M | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
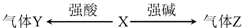
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y在标况下的密度一定是1.96g•L-1 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )
下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | HCl | Cl2 | HClO |
| C | S | SO3 | H2SO4 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com