
| A. | 5.0 mol/L | B. | 0.50 mol/L | C. | 1.0 mol/L | D. | 0.10 mol/L |
分析 n(CaCO3)=$\frac{m}{M}$=$\frac{5.0g}{100g/mol}$=0.05mol,碳酸钙和稀盐酸反应生成可溶性的氯化钙,根据C原子守恒得n(Ca 2+ )=n(CaCO3)=0.05mol,根据c=$\frac{n}{V}$计算钙离子浓度.
解答 解:n(CaCO3)=$\frac{m}{M}$=$\frac{5.0g}{100g/mol}$=0.05mol,碳酸钙和稀盐酸反应生成可溶性的氯化钙,根据C原子守恒得n(Ca 2+ )=n(CaCO3)=0.05mol,根据c(Ca 2+ )=$\frac{n}{V}$=$\frac{0.05mol}{0.1L}$=0.5mol/L,
故选B.
点评 本题考查物质的量浓度的有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,侧重考查学生分析计算能力,注意原子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
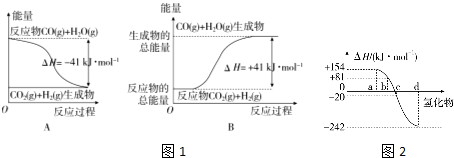
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中C═C双键中有一个键容易断裂 | |
| B. | 乙烯分子中6个原子共平面 | |
| C. | 不能用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| D. | 乙烷和乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
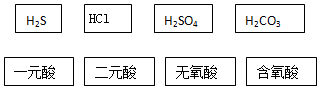
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| B. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| C. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| D. | 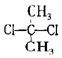 与 与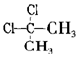 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com