已知A、B、C、D、E、F、G、H是原子序数依次增大的八种元素,A元素是周期表中原子半径最小的元素,B、C和D同周期,E、F和G同周期,A、E 同主族,D、G、H同主族且相邻,B的低价氧化物与C单质分子的电子总数相等,F和G的核电荷数相差4,G的2价简单离子与Ar原子的电子层结构相同.根据以上信息填空:
(1)G元素的二价离子的离子结构示意图为______;H的元素符号为______,H元素在周期表中的位置是______.
(2)C的气态氢化物空间构型是______;A和B形成的四原子非极性分子的结构式是______.
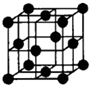
(3)据报道,含题中所述元素B、F和Ni三种元素的晶体具有超导性.该晶体的晶胞结构如图,试写出该晶体的化学式______

(4)由A、C、D、G四种元素形成的强酸的酸式盐的水溶液中各离子浓度由大到小的顺序为______.
(5)科学家用C、D、E三种元素形成的化合物ECD
3和E
2D,在573K时反应制得了离子化合物E
3CD
4;经测定E
3CD
4中各原子的最外层电子都达到了8电子稳定结构,则CD
43-的电子式为______,E
3CD
4与水能剧烈反应转化为常见物质,写出反应的化学方程式:______.


 ,H的元素符号为 Se,位于第四周期第ⅥA族,故答案为:
,H的元素符号为 Se,位于第四周期第ⅥA族,故答案为: ;Se;第四周期第ⅥA族;
;Se;第四周期第ⅥA族; =3,含有C个数为:8×
=3,含有C个数为:8× =1,故该晶体的化学式为:MgCNi3,故答案为:MgCNi3;
=1,故该晶体的化学式为:MgCNi3,故答案为:MgCNi3; ,Na3NO4+H2O═NaNO3+2NaOH.
,Na3NO4+H2O═NaNO3+2NaOH.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: