
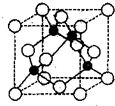
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含 ,故答案为:
,故答案为: ;
;| 6+2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.18 g |
| B、2.21 g |
| C、5.28 g |
| D、4.22 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.
在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.查看答案和解析>>
科目:高中化学 来源: 题型:
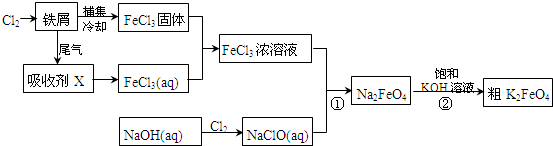
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
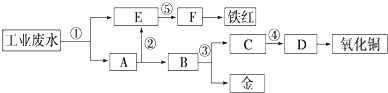
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的硝酸是0.4mol |
| B、消耗氧气的体积为1.68 L |
| C、此反应过程中转移的电子为0.3 mol |
| D、混合气体中含NO21.12 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com