
【题目】超细铜粉有重要用途,工业上可以通过铝黄铜合金(含Cu、Al、Zn)制超细铜粉。某小组在实验室模拟制备超细铜粉的方法如下:
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和____。
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)____mL。
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为____。
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数________。
【答案】 C 27.2(或27.17) 2[Cu(NH3)4]SO4 + 3SO2 + 4H2O=2 NH4CuSO3 + 3(NH4)2SO4 n(H2)=0.1344L÷22.4L·mol-1=0.006mol
n(SO2)=0.3808L÷22.4L·mol-1=0.017mol
∵Zn、Al与稀硫酸产生的H2和Zn、Al与浓硫酸产生的SO2的物质的量相同,
∴n(Cu)=n(SO2)-n(H2)=0.017mol-0.006mol=0.011mol
铜的质量分数为:![]() =70.4%
=70.4%
【解析】分析:(1)依据Cu的活泼性分析;(2)按照稀释定律来计算;(3)根据质量守恒定律书写生成NH4CuSO3的化学反应方程式;(4)根据守恒关系计算合金中铜的质量分数。
详解:(1)由于Cu不溶于稀硫酸,也不溶于盐酸,虽然能溶于FeCl3,但会引入新的杂质,可以加入稀硫酸和热空气,将铜氧化,又不引入新的杂质,因此,本题答案为:C。
(2)先求出浓硫酸的物质的量浓度,根据C=![]() =
=![]() mol/L=18.4mol/L,根据稀释定律:C1V1=C2V2,18.4mol/L
mol/L=18.4mol/L,根据稀释定律:C1V1=C2V2,18.4mol/L![]() V=1mol/L
V=1mol/L![]() 500mL,解得,V=27.2mL;因此,本题答案为:27.2(或27.17);
500mL,解得,V=27.2mL;因此,本题答案为:27.2(或27.17);
(3)向[Cu(NH3)4]SO4溶液中通入SO2,生成NH4CuSO3,发生的是氧化还原反应,铜的化合价降低被还原,二氧化硫部分被氧化生成SO42-,根据得失电子守恒和原子守恒写出生成NH4CuSO3的化学反应方程式为2[Cu(NH3)4]SO4 + 3SO2 + 4H2O=2 NH4CuSO3 + 3(NH4)2SO4。
(4)合金中的Al、Zn和稀硫酸反应生成氢气,n(H2)=0.1344L÷22.4L·mol-1=0.006mol
合金中Cu、Al、Zn和足量浓硫酸反应生成SO2,n(SO2)=0.3808L÷22.4L·mol-1=0.017mol
因Zn、Al与稀硫酸产生的H2和Zn、Al与浓硫酸产生的SO2的物质的量相同,所以n(Cu)=n(SO2)-n(H2)=0.017mol-0.006mol=0.011mol,
铜的质量分数为:![]() ×100%=70.4%。
×100%=70.4%。


科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 的分子结构,下列说法正确的是( )
的分子结构,下列说法正确的是( )
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 除苯环外的其余碳原子不可能都在一条直线上
C. 12个碳原子不可能都在同一平面上
D. 所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物异搏定合成路线中,其中的一步转化如下:
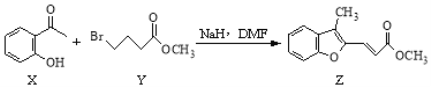
下列说法正确的是
A. Y的分子式为C5H9O2Br
B. X分子中所有原子在同一平面内
C. Z和足量H2加成后的分子中有5个手性碳原子
D. 等物质的量的X、Z分别与溴水反应,最多消耗Br2的物质的量之比1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料等工业中有重要应用,某工厂以含铅锌烟气(主要成分是ZnO、PbO,还有少量FeO、CuO)制备活性ZnO的工艺流程如下:

(1)下图为温度与Zn、Pb元素浸出率的关系图,“酸浸”时采用30℃而不是更高的温度的原因是:①减少盐酸挥发;②____。

(2)“氧化”的目的是除去酸浸液中的Fe2+,在pH约为5.1的溶液中,加入高锰酸钾溶液,生成MnO2和Fe(OH)3沉淀,该反应的离子方程式为____。
(3)①若“过滤I”所得的滤液浑浊,则处理的方法为____。
②“除杂”时,滤渣Ⅱ的主要成分是Cu、Pb,试剂X应为____。
(4)在“过滤Ⅱ”后的溶液中加入Na2CO3溶液,生成碱式碳酸锌[Zn2(OH)2CO3]等物质。
①该反应的化学方程式为____。
②检验碱式碳酸锌洗涤干净的操作为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化学课外小组用如右图一装置制取溴苯。先向分液漏斗中 加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)观察到A中的现象是_________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡, 写出有关反应的化学方程式_____________________________。
(3)C中盛放CCl4的作用是________________________________。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是________________________________________。
II.实验室用下图所示的装置制取乙酸乙酯。

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下:__________,然后轻振荡使其混合均匀。
(2)浓硫酸的作用是:① _______________;② ______________。
(3)右边装置中通蒸气的导管要插在液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是___________________。
(4)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(5)若加的是C2H518OH写出制乙酸乙酯的方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com