
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( )
A. △H2>△H3B. △H1+△H3 =△H2
C. △H1<△H3D. △H1+△H2>△H3
【答案】C
【解析】
① 胆矾溶于水时,溶液温度降低,反应为CuSO45H2O(s)=Cu2+(aq)+SO42 (aq)+5H2O(l) △H1>0;
② 硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42 (aq)△H2<0;
③ 已知CuSO45H2O(s)=CuSO4(s)+5H2O(l)△H3;
依据盖斯定律①②得到③:△H3=△H1△H2,由于△H2<0,△H1>0,则△H3>0,
A.分析可知△H3>0,而△H2<0,则△H3>△H2,故A错误;
B. △H3=△H1△H2,则△H1=△H3+△H2,故B错误;
C.上述分析可知:△H2<0,△H3>0,△H3=△H1△H2则△H2=△H1△H3<0,即△H1<△H3,故C正确;
D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H3>△H1+△H2,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
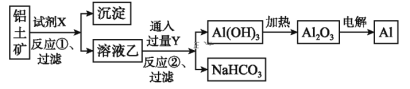
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计如图实验装置(夹持和加热装置略去)制备Cl2,并探究氯气的相关性质。
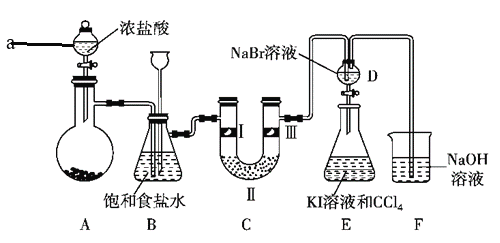
回答下列问题:
⑴ 装置中a玻璃仪器的名称为_____________;整套装置装配完毕后,首先进行的操作是______________,再添加试剂。
⑵ 若A装置中的固体药品为MnO2,其化学方程式为_______________________。若A装置中的固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为_________mol(结果保留两位小数)。
⑶ 装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是_________、_____________。
⑷ 设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能是_____________。
⑸ 甲同学提出,装置F中改用过量的Na2SO3溶液,乙同学认为此法不可行。请用离子方程式解释乙认为不可行的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和②B. ②和④C. ③和④D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJmol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJmol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
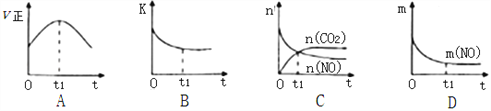
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将Mg条放入浓NH4Cl溶液中产生无色气体,该气体是________(填化学式),请用离子方程式解释该现象产生的原因________________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)____________,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
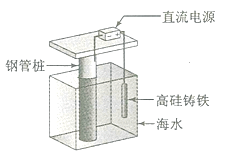
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以乙苯催化脱氢制取苯乙烯的反应如下:
![]() (g)
(g)![]() (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。
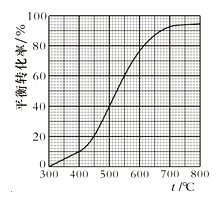
已知:气体分压(p分)= 气体总压(p总)×体积分数。不考虑副反应,下列说法正确的是
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() × p总
× p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com