
科目:高中化学 来源:不详 题型:单选题
| A.氢键比分子间作用力强,所以它属于化学键 |
| B.冰中存在氢键,水中不存在氢键 |
| C.分子间形成的氢键使物质的熔点和沸点升高 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
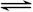 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物的总能量大于生成物的总能量 |
| B.反应物的总能量小于生成物的总能量 |
| C.反应物的总能量等于生成物的总能量 |
| D.无法确定反应物总能量和生成物总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 试剂1 | 试剂2 | 混合 前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
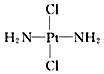 ,b为
,b为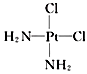 。两者有不同的特性,a比b易溶于水。则a与b的关系为( )
。两者有不同的特性,a比b易溶于水。则a与b的关系为( )| A.同分异构体 | B.同素异形体 | C.同位素 | D.同种物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B.HF、HCl、HBr、HI的热稳定性依次减弱 |
| C.金属锂、钠、钾的熔点依次降低 |
| D.NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4CH4(g)+O2(g)+2H2O(g)===4CO(g)+10H2(g) |
| B.7CH4(g)+3O2(g)+H2O(g)==="7CO" (g)+15H2(g) |
| C.3CH4(g)+O2(g)+H2O(g)===3CO(g)+7H2(g) |
| D.5CH4(g)+2O2(g)+H2O(g)===5CO(g)+11H2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com