
 I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中:
I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中: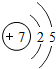 .
.分析 I(1)可以用作食品保护气的物质应该具有的性质有:化学性质不活泼,无毒,对人体没有副作用;
(2)能和酸反应生成盐的物质应该具有碱性;
(3)可以作氮肥、遇碱会放出带刺激性气味气体的物质为铵盐;铵盐和氢氧化钠等强碱溶液能发生复分解反应.
II(1)氮元素原子核外电子排布为1s22s22p3,主族元素周期数=电子层数,主族族序数=最外层电子数,据此判断碳元素在周期表中位置,画出其原子结构示意图;
(2)氮的常见氢化物为氨气,氨气分子中氮原子与氢原子之间形成1对共用电子对,结构式中用“-”表示共用电子对;根据价层电子对互斥理论确定氨气空间构型;
(3)铜与稀硝酸反应生成硝酸铜、NO与水;
NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2;
(4)氮氧化物与氨气发生的反应是氧化还原反应,氮氧化物把氨气氧化为氮气,本身被还原为氮气,可以利用反应方程式通过设未知列方程组计算;也可以根据氧化还原反应的电子守恒计算;也可以利用平均值法计算;
(5)向稀硝酸中加入铁粉时,开始先生成Fe(NO3)3,当铁过量时,过量的铁再与 Fe(NO3)3反应生成 Fe(NO3)2,反应涉及两个方程式Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe=3 Fe(NO3)2.
解答 解:I(1)N2的化学性质不活泼,无毒,可以用作食品保护气,
故答案为:N2;
(2)能和酸反应生成盐的物质应该具有碱性,在常温下为气态的物质是NH3;
故答案为:NH3;
(3)可以作氮肥、遇碱会放出带刺激性气味气体的物质为铵盐,铵盐都是易溶于水的物质,铵盐和氢氧化钠等强碱溶液能发生复分解反应,生成氨气和水,离子反应方程式为:NH4++OH-=NH3↑+H2O,
故答案为:NH4++OH-=NH3↑+H2O.
II(1)氮的原子序数为7,其核外电子排布为1s22s22p3,则N元素位于周期表中第二周期ⅤA族,其原子结构示意图为: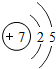 ,
,
故答案为:第二周期ⅤA族;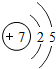 ;
;
(2)氮的常见氢化物为氨气,氨气中存在3个氮氢键,电子式为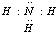 ,用“-”表示共用电子对,氨气的结构式为:
,用“-”表示共用电子对,氨气的结构式为: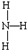 ,氨气中氮原子含有3个σ键和1个孤电子对,所以其价层电子对个数是4,该分子属于三角锥形结构,氨电离产生氢氧根离子,使溶液呈碱性,化学方程式为NH3•H2O?NH4++OH-,
,氨气中氮原子含有3个σ键和1个孤电子对,所以其价层电子对个数是4,该分子属于三角锥形结构,氨电离产生氢氧根离子,使溶液呈碱性,化学方程式为NH3•H2O?NH4++OH-,
故答案为: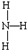 ;三角锥形;NH3•H2O?NH4++OH-;
;三角锥形;NH3•H2O?NH4++OH-;
(3)铜与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;NaNO2;
(4)根据反应可知:氨气被氧化为氮气,NH3~N2~3e-;一氧化氮被还原为氮气,NO~N2~2e-二氧化氮被还原为氮气NO2~N2~4e-
设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3.5L,根据电子守恒可知:3.5L×3=2x+4×(3-x),x=0.75L,二氧化氮体积为2.25L,则相同条件下,混合气体中NO和NO2的体积比等于物质的量之比=0.75:2.25=1:3;
故答案为:1:3;
(5)向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为4mol利用方程式可计算出生成的 Fe(NO3)3为1mol,则硝酸为1mol生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3,
Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,设生成的 Fe(NO3)2物质的量xmol,则利用方程式可求得,
2Fe(NO3)3+Fe=3 Fe(NO3)2,
2 3
0.25mol-x x
x=0.15,即P=0.15,
再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)),所以 n(Fe)=0.3mol即n2=0.3mol,
P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,物质的量为0.15mol,加入铁最后到r点,溶质全部为 Fe(NO3)2,2Fe(NO3)3+Fe=3 Fe(NO3)2消耗铁物质的量为0.075mol,生成硝酸亚铁0.225mol,则n3=0.375mol,
故答案为:Fe(NO3)2;0.375;0.15.
点评 本题考查了含氮物质的性质,侧重考查了氮氧化物发生的化学反应、氧化还原反应电子转移、铁与稀硝酸的反应,注意铁和硝酸谁多谁少,以及加入的顺序,注意(5)图象中曲线的变化实质理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ④⑤⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | 植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程 | |
| C. | 在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| D. | 热化学方程式中的△H的值与反应物的用量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | Z>X>Y | D. | Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7 mol/L | B. | c(OH-)=1×10-7mol/L | ||
| C. | c(H+)=c(OH-) | D. | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 926kJ | B. | 463 kJ | C. | 402.5kJ | D. | 23115 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脚气病 | B. | 坏血病 | C. | 夜盲症 | D. | 神经炎 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 大理石和稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | FeCl2溶液与Cl2的反应:Fe2++Cl2=Fe3++2Cl- | |
| D. | Cl2与H2O反应:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com