
【题目】向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是

A.该过程中产生标准状况下的氢气4.48 L
B.向c点处的反应液中加入稀盐酸后无明显现象
C.图中a=1.5、b =1.5
D.当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
【答案】D
【解析】
试题分析:A.硝酸与铁反应生成硝酸铁、NO和水,不生成氢气,A项错误;B.c点处的溶液是硝酸亚铁,若加入盐酸,H+、NO3-和Fe2+发生氧化还原反应生成Fe3+,溶液变为黄色,B项错误;C.向硝酸中加入铁粉发生的反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,硝酸的物质的量为0.4mol,则消耗铁的物质的量为0.1mol,b=0.1mol,生成硝酸铁0.1mol,随后发生反应2Fe(NO3)3+Fe=3Fe(NO3)2,生成硝酸亚铁为0.15mol,则a=0.15,C项错误;D.根据上述分析,当加入铁粉n mol时(0.1<n<0.15),发生反应为2Fe(NO3)3+Fe=3Fe(NO3)2,参加该反应的铁为n-0.1,消耗硝酸铁为2(n-0.1),则溶液中n(Fe3+)=(0.3-2n)mol,D项正确;答案选D。


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,
2PbSO4+2H2O,
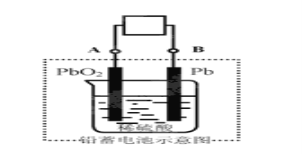
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-=PbSO4
C.充电时:铅蓄电池的负极应与充电器电的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的( )
A.②④
B.③⑤
C.①②④
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 硫酸、CuSO4·5H2O、苛性钾 B. 硫酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰 D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲壳质在食品工业中作为增稠剂、吸附澄清剂。但使用中要控制用量,否则产生副作用。甲壳质(C8H13NO5)n属于 ( )
A. 氧化物 B. 无机物 C. 有机物 D. 电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属元素M和N,其中M单质是人类使用最广泛和最多的金属,N元素的氧化物和氢氧化物均具有两性,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化M可以与一氧化碳发生下列反应:M2O3(s)+3CO(g)![]() 2M(s)+3CO2(g)
2M(s)+3CO2(g)
①元素M名称 ,该反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有M2O3粉末的密闭容器中通入CO气体,10min后,生成了单质M11.2g,则10min内CO的平均反应速率为 。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
① ,
② 。
(3)某些金属氧化物粉末和N单质粉末状固体在镁条的引燃下可以发生反应。下列反应速率(v)和温度(T)的关系示意图中与该反应最接近的是 。

(4)写出N的氢氧化物在水中发生碱式电离的电离方程式: ,欲使上述平衡体系中N简单阳离子浓度增加,可加入的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述,不正确的是 ( )
A. 布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B. 光线透过胶体时,胶体发生丁达尔效应
C. 用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D. 胶体微粒具有较大的比表面积,能吸附阳离子或阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com