
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出氯化氢的物质的量,然后根据c=$\frac{n}{V}$计算出该盐酸的物质的量浓度;
(2)取出溶液浓度不变,根据n=cV计算出含有HCl的物质的量,然后利用电子守恒计算出消耗铁定物质的量,最后利用m=nM计算出消耗铁的质量.
解答 解:(1)标准状况下,4.48L HCl气体的物质的量为:n(HCl)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
则该溶液中HCl的物质的量浓度为:c(HCl)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:该溶液中HCl的物质的量浓度为1.0mol/L;
(2)取出的20.00mL溶液浓度为1mol/L,取出溶液中含有HCl的物质的量为:1mol/L×0.02L=0.02mol,
根据电子守恒,消耗铁的物质的量为:n(Fe)=$\frac{0.02mol×1}{2}$=0.01mol,
所以消耗铁的质量为:m(Fe)=56g/mol×0.01mol=0.56g,
答:取出20.00mL该溶液,往该溶液中加入铁片,则消耗0.56g金属铁.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握电子守恒在氧化还原反应计算中的应用方法,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期ⅠA族 | B. | 第三周期ⅠA族 | C. | 第二周期ⅦA族 | D. | 第三周期ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
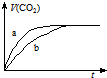 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )| A. | 两份大理石一定有剩余 | |
| B. | 两份盐酸一定反应完全 | |
| C. | 曲线a表示的是块状大理石样品与盐酸反应 | |
| D. | 曲线b表示的是块状大理石样品与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
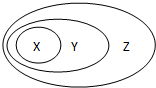 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )| X | Y | Z | |
| A | 盐酸 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 氧化铝 | 电解质 | 化合物 |
| D | KHSO4 | 酸 | 无机物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是由有机物和无机物组成的复杂混合物 | |
| B. | 煤的干馏是工业上获得芳香烃的一种重要来源 | |
| C. | 煤在空气中加强热的过程叫做煤的干馏 | |
| D. | 煤焦油中含有苯和甲苯,可以用分馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
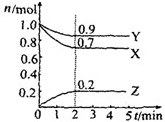 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com