
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算混合气体物质的量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量;
(2)设CO2和CO的物质的量分别为xmol、ymol,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算.
解答 解:(1)混合气体物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,混合气体的平均摩尔质量为$\frac{18g}{0.5mol}$=36g/mol,
答:混合气体的平均摩尔质量为36g/mol;
(2)设CO2和CO的物质的量分别为xmol、ymol,则:$\frac{44x+28y}{x+y}$=36,整理可得x:y=1:1,
答:CO2和CO的物质的量之比为1:1.
点评 本题考查混合物计算,难度不大,注意理解掌握以物质的量为中心的有关计算,(2)中可以利用十字交叉法计算.


科目:高中化学 来源: 题型:解答题
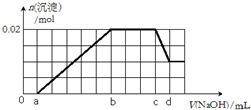 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲:NaOH; 乙:稀盐酸 | B. | 甲:水; 乙:氢氧化钠溶液 | ||
| C. | 甲:氢氧化钠溶液; 乙:水 | D. | 甲:稀盐酸; 乙:氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


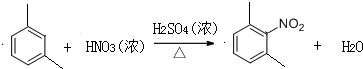 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
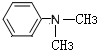 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | pH=13的溶液中:Na+、CO32-、K+、HCO3- | |
| C. | 在无色溶液中:Cu2+、Ca2+、SO42-、Cl- | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
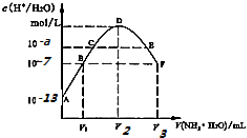
| A. | 稀硫酸的浓度为0.1mol/L | |
| B. | C点溶液pH=14-a | |
| C. | E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | B到D、D到F所加氨水体积一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com