
��֪���Ϊ2L�ĺ����ܱ������з�����Ӧ��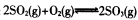 ������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
��1��һ�������£�����2 mol SO2��g����2 mol O2��g����20 s���SO2������ٷֺ���Ϊ12��5%������SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ____����ʱ�����ܱ������ڻ�������ѹǿ�Ƿ�Ӧǰ��____����
��2���������������Ϊ�жϣ�1���п��淴Ӧ�ﵽƽ��״̬���ݵ��ǣ�����ţ�____��
��
�ڻ��������ܶȲ���
�ۻ�������ƽ����Է�����������
�ܸ������Ũ�ȶ����ٷ����仯
��3����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���ı仯�Ĺ�ϵ�������в�ͬʱ����У�SO3�İٷֺ�����ߵ��ǣ� ��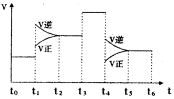

��ͼ����������Ϊt3ʱ�ı��������������� ��
t6ʱ���������������ϵ�г�������SO3���ٴ�ƽ���
SO2������ٷֺ�����t6ʱ �����\��С�����ڡ�����
��4����ͼ��P�ǿ�����ƽ�л����Ļ���������ͬ�¶�ʱ����A�����г���4 mol SO3��g�����ر�K����B�����г���2 mol SO3��g�����������ֱ�����Ӧ��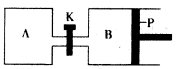
��֪��ʼʱ����A��B�������ΪaL���Իش�
�ٷ�Ӧ�ﵽƽ��ʱ����B�����Ϊ1��2a L������B��SO3ת
����Ϊ____
������K��һ��ʱ������´ﵽƽ�⣬����B�����Ϊ __L����ͨ��������������Բ��ƣ��Ҳ������¶ȵ�Ӱ�죩��
��5����֪�������ȼ����Ϊ��H=-296kJ/mol�����ⶨ��S��s������120gSO3��g���ɷ���592��5kJ����д��SO2��g����������SO3��g�����Ȼ�ѧ����ʽ____��
��1��0.04mol/(L��s)(2��) 0.8��(2��)
��2���ۢ�(2��)
��3��A(1��) �������(1��) С(1��)
��4��40�G(2��) 2.6a(2��)
��5��2SO2 (g) + O2 (g)  2SO3 (g)����H�� ��198 kJ��mol-1(2��)
2SO3 (g)����H�� ��198 kJ��mol-1(2��)
���ߣ� SO2 (g) + 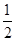 O2 (g)
O2 (g)  SO3 (g)����H�� ��99 kJ��mol-1
SO3 (g)����H�� ��99 kJ��mol-1
������1�����������2SO2 + O2  2SO3��
2SO3��
ʼ�� 2mol 2mol 0 mol
���� 2xmol xmol 2xmol
ƽ�� (2-2x) mol (2-x) mol 2xmol
�������У� ��֮�ã�x=0.8mol
��֮�ã�x=0.8mol
������SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ��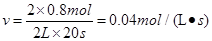
���ݰ����ӵ����ɵ����ۣ�ͬ��ͬ��������£����ʵ���֮�ȵ���ѹǿ֮�ȣ��У�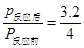 ��˷�Ӧ���ѹǿΪ��Ӧǰ��0.8����
��˷�Ӧ���ѹǿΪ��Ӧǰ��0.8����
��2���������ֹ�ϵ�������Ӧ���Dz����Ƿ�ﵽƽ��״̬һֱ���ڣ�����ȷ�����л��������ܶ�Ҳ��ʱ�̲���ģ���Ϊ��Ӧǰ�������壬�����غ㣬��������ǹ̶��ġ�����ȷ���۸÷�Ӧǰ������һ���������������������ʵ�����С�ķ���������Ǵﵽƽ���һ����Ҫ��־����ȷ���ܸ������Ũ�Ȳ��ٱ仯ʱ����ζ�Ÿ����Ũ��t1��һ��ֵ����ȷ��
��3��t1��t2ƽ�������ƶ���t3��t4ƽ�ⲻ�ƶ�t4 ��t5ƽ�������ƶ������ѡA
t3��t4���淴Ӧ����ͬ�ȳ̶ȸı䣬���÷�Ӧǰ��������ı䣬ֻ���Ǽ��������
�������ʱ�����������SO3���൱������ѹǿ��ƽ�������ƶ���
��4�������������2SO3  2SO2 + O2 ��
2SO2 + O2 ��
ʼ�� 2mol 0 mol 0 mol
���� 2x mol 2x mol x mol
ƽ�� (2-2x) mol (0+2x) mol L (0+x) mol
���ݰ����ӵ����ɵ����ۣ�ͬ��ͬѹ�����£����ʵ���֮�ȵ������֮�ȣ��У�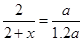 ��֮�ã�x=0.4 ����ת����Ϊ40�G
��֮�ã�x=0.4 ����ת����Ϊ40�G
������K��A��B�ͳ���һ������������ٴδﵽƽ��ʱ�������Ӧ��Ϊ3��1.2aL=3.6aL����ȥA��ԭ����1L��B�������Ӧ����2.6aL��
��5�� �������У�1 mol��S��������1 mol��SO3��ų�592.5/1.5=395 kJ���������ٸ�駸�˹���ɿ�֪1 mol��SO2��g����������1 mol��SO3��g���ܷų�444-395="99" kJ����������ˣ�
2SO2 (g) + O2 (g)  2SO3 (g)����H�� ��198 kJ��mol-1
2SO3 (g)����H�� ��198 kJ��mol-1
���ߣ�SO2 (g) + 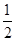 O2 (g)
O2 (g)  SO3 (g)����H�� ��99 kJ��mol-1
SO3 (g)����H�� ��99 kJ��mol-1
���㣺��ѧ��Ӧ���ʸ���ѧƽ�⾭�Լ���˹���ɵ����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����仯����������������������е���ϵ��������һ֧15mL���Թܣ�����NO������ˮ���У����Թ��л���ͨ��һ�������������Թ���Һ���ȶ�ʱ��ʣ������3mL����ͨ���������������Ϊ mL��
��Ŀǰ����������������Ⱦ�ж��ַ�����
��1����CH4����ԭ��������������������������Ⱦ����֪��
��CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ��H="-574kJ/mol"
��CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ��H="-1160kJ/mol"
��H2O(g)= H2O(l) ��H=-44kJ/mol
д��CH4(g)��NO2(g)��Ӧ����N2(g) ��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ ��
��2���û���̿��ԭ��������������йط�ӦΪ��
ij�о�С��������ܱ���������һ�����Ļ���̿��NO�����£�T0C)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�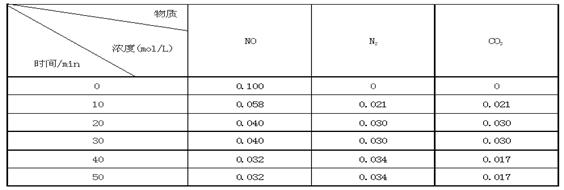
�ٲ�����Ϊ�жϷ�Ӧ�ﵽ��ѧƽ��״̬��������_______ ����ѡ����ĸ���ţ�
A��������CO2��Ũ�ȱ��ֲ���
B��v��(N2)="2" v��(NO)
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
E����������ƽ����Է����������ֲ���
��ǰ20���ӣ�ƽ����Ӧ����v(NO)= ��v(NO)=��0��1- 0��04��/ 20 = 0��003mol��L-1�� min-1
����T0Cʱ���÷�Ӧ��ƽ�ⳣ��Ϊ_______(������λС��)��
����30 min���ı�ijһ������Ӧ���´ﵽƽ�⣬��ı��������_______ ��
��3����ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2,�䷴ӦΪ�� 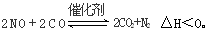
�о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ������±��С�
| ʵ���� | T(0C) | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�� ��mol/L�� | �����ı� �����(m2/g) |
| �� | 280 | 1��20��10-3 | 5��80��10-3 | 82 |
| �� | a | b | c | 124 |
| �� | 350 | d | e | 124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪H��(aq)��OH��(aq)=H2O(l) ��H����57.3 kJ��mol��1���ش��й��кͷ�Ӧ�����⡣
��1����0.1 mol Ba(OH)2���ϡ��Һ������ϡ���ᷴӦ���ܷų�________kJ������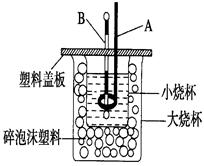
��2����ͼװ��������A�������� ������ĭ���ϵ������� ��
��3����ͨ��ʵ��ⶨ�к��ȵĦ�H�������������ڣ�57.3 kJ��mol��1����ԭ�������
��
��4������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�� (�ƫ����ƫС��������Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ϊʵ�� �����ܼ��š� �͡���̼���á���һ���������ν�CO2ת��Ϊ��������Դ��
��1��25�棬1.01��105Paʱ��16gҺ̬�״���CH3OH����ȫȼ�գ����ָ���ԭ״̬ʱ���ų�����363.3kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��2��Ŀǰ����ҵ�ϳ���CO2������ȼ�ϼ״����ֽ�������ʵ�飺�����Ϊl L���ܱպ��������У�����l mol CO2��3mol H2��һ�������·�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H����49.0 kJ/mol��
CH3OH(g)+H2O(g) ��H����49.0 kJ/mol��
���CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
�ٸ÷�Ӧ��ƽ�ⳣ������ʽK�� ��
�ڴӷ�Ӧ��ʼ��ƽ��ʱ��CH3OH��ƽ����Ӧ����v(CH3OH)�� ��ע����λ����H2��ת���ʣ� ��
������˵���У���˵��������Ӧ�ﵽƽ��״̬����
A��ÿ����1mol CO2��ͬʱ����1mol CH3OH
B��CO2��H2��CH3OH��H2O�����ʵ����ı�Ϊ1��3��1��1
C�������������ѹǿ���ٸı�
D��������������ܶȲ��ٸı�
�����д�ʩ�У���ʹ����ƽ��״̬������Ӧ�����ƶ�����
A�������¶� B����CH3OH(g)����ϵ�з���
C��ʹ�ø�Ч���� D�����º����ٳ���1 molCO2��3 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I.��ѧ��һֱ�����ڡ��˹��̵����ķ����о���Ŀǰ�ϳɰ��ļ���ԭ��Ϊ�����������ڸ��¸�ѹ�������������ɰ�����һ�������£���һ��2L���ܱ������г���2molN2��6molH2����Ӧ��ƽ��ʱ����NH3��Ũ��Ϊ0.5mol/L�����ų�QkJ�������÷�Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ______��
II.��֪��N2O4(g) 2NO2(g) ��H����57.20kJ/mol��
2NO2(g) ��H����57.20kJ/mol��
��1000Cʱ����0.100molN2O4�������lL���ݳ�յ��ܱ������У�ÿ��һ��ʱ��Ը������ڵ�����Ũ�Ƚ��з����õ��±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol | 0.000 | 0.060 | c2 | 0.120 | 0.120 |

 N2O4(g)(g) ��H����57.20kJ/mol�����º����·�Ӧ��ͬʱ��ֱ�����ϵ��NO2�İٷֺ����ֱ�Ϊa1��a2����֪T1<T2,��a1____a2(ѡ��A��B��C��D��գ���
N2O4(g)(g) ��H����57.20kJ/mol�����º����·�Ӧ��ͬʱ��ֱ�����ϵ��NO2�İٷֺ����ֱ�Ϊa1��a2����֪T1<T2,��a1____a2(ѡ��A��B��C��D��գ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪2H2��g��+O2��g��=2H2O��l����H����571.6 kJ/mol��
CO��g����1/2O2��g����CO2��g����H����283.0 kJ/mol��ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6 gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ___________��
��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫���ɹ���ȼ�ϵ�أ���֪��ȼ�ϵ�ص��ܷ�Ӧʽ�ǣ�2CH3OH +3O2+4OH-=2CO32-+6H2O����ȼ�ϵ�ط�����Ӧʱ����������Һ��PH__________ (����� ����С�� ���䡱)�õ�صĸ�����ӦʽΪ_________________��
��3�� ������ȼ�ϵ�ؽ��д�ͭ�ľ�������ͭӦ���ӵ�Դ��________�����ô�ͭ�������ص�������ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㡣
��1����CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3(g)��CO2(g)��NH2CO2NH4(s)����H����159.47 kJ��mol��1
��NH2CO2NH4(s)��CO (NH2)2(s)��H2O(g)����H��a kJ��mol��1
��2NH3(g)��CO2(g)��CO(NH2)2(s)��H2O(g)����H����86.98 kJ��mol��1
��aΪ ��
��2����Ӧ2NH3(g)��CO2(g) CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ�Т���������Ϊ�ϳ����а���ͬ��̼�� [n(NH3)/n(CO2)]��ˮ̼��[n(H2O)/n(CO2)]Ͷ��ʱ������̼ת���ʵ������
CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ�Т���������Ϊ�ϳ����а���ͬ��̼�� [n(NH3)/n(CO2)]��ˮ̼��[n(H2O)/n(CO2)]Ͷ��ʱ������̼ת���ʵ������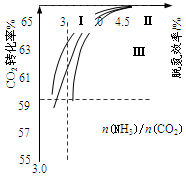
�����ߢ�ˮ̼�ȵ���ֵ�ֱ�Ϊ��
A. 0.6��0.7 B. 1��1.1 C. 1.5��1.61
������Ӧѡ��ˮ̼�ȵ���ֵΪ ��ѡ����ţ���
�������а�̼���˿�����4.0���ң�������4.5��ԭ������� ��
��3�����ؿ�����ʪ�������ѵ����գ��䷴Ӧԭ��Ϊ��
NO��NO2��H2O��2HNO2 2HNO2��CO(NH2)2��2N2����CO2����3H2O��
�ٵ�������NO��NO2��������Ӧ��ϵ����ʱ�ѵ�Ч����ѡ���������V(NO)��V(NO2)��5��1ʱ����ͨ��һ�����Ŀ�����ͬ��ͬѹ�£�V(����)��V(NO)�� �����������������������ԼΪ20%����
����ͼ�����غ������ѵ�Ч�ʵ�Ӱ�죬�Ӿ��������Ͽ��ǣ�һ��ѡ������Ũ��ԼΪ %��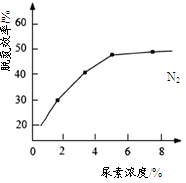
��4����ͼ��ʾʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ����������ṩ������ͬʱ����ʵ�ֵ��̶�������ȼ�ϵ�ء���д���õ�ص�������Ӧʽ �������пɷ����������A�Ļ�ѧʽΪ ��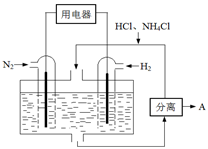
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
CO��NO��NO2��SO2�ȶ�����Ⱦ�������к����壬������л��������ǽ��ܼ��ŵ���Ҫ���⡣
��1��������������ֱ����������л������������ ��
��2��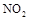 ��������
��������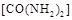 ��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��
��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��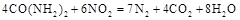 �������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��
�������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��
��3��SNCR-SCR��һ�����͵�����������������ȥ�����е�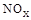 ��,�������з�������Ҫ��Ӧ�У�
��,�������з�������Ҫ��Ӧ�У�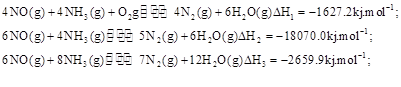
��Ӧ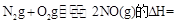 KJ/mol
KJ/mol
��4��CO�����ںϳɼ״�����Ӧ����ʽΪ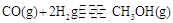 ����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
��÷�Ӧ��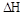 0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��
0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��
��5����ҵ���ð�ˮ����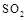 ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��
ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��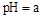 ����
����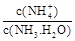 = ���ú�a�Ĵ���ʽ��ʾ����֪
= ���ú�a�Ĵ���ʽ��ʾ����֪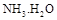 �ĵ��볣��
�ĵ��볣��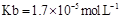 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��֪�����Ȼ�ѧ����ʽ��
��C(s)+O2(g)=CO2(g) ��H1 ����393.5 kJ��mol-1
��2CO(g)+O2(g)=2CO2(g) ��H2 ����566.0 kJ��mol-1
��2H2(g)+O2(g)=2H2O(l) ��H3 ����571.6 kJ��mol-1
ͨ�����㣨Ҫ�м�����̣���д��1 mol C��Һ̬H2O��Ӧ����CO��H2���Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com