
|
将20 mL 0.4 mol·L-1硝酸铵溶液跟50 mL 0.1 mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 | |
| [ ] | |
A. |
c( |
B. |
c( |
C. |
c(Ba2+)>c( |
D. |
c( |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:三点一测丛书 高中化学(选修)化学反应原理 江苏版课标本 江苏版课标本 题型:013
|
将20 mL 0.4 mol/L硝酸铵溶液跟50 mL 0.1 mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 | |
| [ ] | |
A. |
c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+) |
B. |
c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+) |
C. |
c(Ba2+)>c(NO3-)>c(OH-)>c(NH4+) |
D. |
c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高一化学 山东科学技术出版社 鲁教版 题型:038
已知某主族元素X的原子核内质子数和中子数之比为1∶1,在含该金属阳离子的溶液中,该金属阳离子的浓度为0.8 mol/L,10 mL这种溶液恰好能将20 Ml 0.4 mol/L的Na2CO3溶液中CO32-全部沉淀,且10 mL这种溶液含该金属阳离子0.32 g,根据计算推断,X是什么元素,画出其阳离子结构示意图及指出在周期表中的位置.
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高一化学 山东科学技术出版社 鲁教版 题型:038
已知某主族元素X的原子核内质子数和中子数之比为1∶1,在含该金属阳离子的溶液中,该金属阳离子的浓度为0.8 mol/L,10 mL这种溶液恰好能将20 mL 0.4 mol/L的Na2CO3溶液中CO32-全部沉淀,且10 mL这种溶液含该金属阳离子0.32 g,根据计算推断,X是什么元素,画出其阳离子结构示意图及指出其在周期表中的位置.
查看答案和解析>>
科目:高中化学 来源:云南省昆明八中2012届高三上学期期中考试化学试题 题型:022
已知:①25℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10.②25℃时,2.0×10-3 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

■(图有问题)
请根据信息回答下列问题:
(1)25℃时,将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1 HSCN溶液分别与20 mL 0.10 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下图:
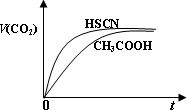
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是________,
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”).
(2)25℃时,HF电离平衡常数的表达式Ka=________,25℃时,HF电离平衡常数Ka________.
(3)25℃时,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com