
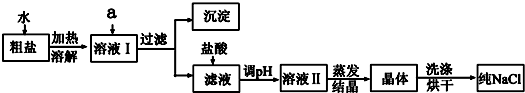
分析 欲除去溶液I中的MgCl2、CaCl2、Na2SO4,为了不增加新的杂质,根据酸、碱、盐的性质及复分解反应的条件可知,用NaOH除掉氯化镁,用BaCl2除掉硫酸钠,用Na2CO3除掉氯化钙与多余的BaCl2,最后将沉淀滤出,向混合液加入盐酸,除去剩余的氢氧根、碳酸根离子,最后得到氯化钠溶液,蒸发结晶得到氯化钠的固体物质.
(1)除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
(2)滤液中加盐酸的作用,应考虑除去NaOH、Na2CO3溶液;
(3)蒸发结晶得到晶体的操作是:蒸发、过滤,用到玻璃仪器:蒸发皿、玻璃棒;
(4)根据粗盐提纯时,加入Na2CO3后与HCl反应也得到了一定量的NaCl来分析判断.
解答 解:欲除去溶液I中的MgCl2、CaCl2、Na2SO4,为了不增加新的杂质,根据酸、碱、盐的性质及复分解反应的条件可知,用NaOH除掉氯化镁,用BaCl2除掉硫酸钠,用Na2CO3除掉氯化钙与多余的BaCl2,最后将沉淀滤出,向混合液加入盐酸,除去剩余的氢氧根、碳酸根离子,最后得到
氯化钠溶液,蒸发结晶得到氯化钠的固体物质.
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,为了不增加新的杂质,根据酸、碱、盐的性质及复分解反应的条件可知,用NaOH除掉氯化镁,用BaCl2除掉硫酸钠,用Na2CO3除掉氯化钙与多余的BaCl2,正确滴加顺序依次为:过量BaCl2溶液、过量Na2CO3溶液,产生的难溶物分别是Mg(OH)2、CaCO3、BaCO3、BaSO4.
故答案为:过量的BaCl2、过量的Na2CO3;Mg(OH)2、CaCO3、BaCO3、BaSO4;
(2)在滤液中加盐酸可以跟过量的NaOH和过量的Na2CO3反应,除去NaOH、Na2CO3溶液,反应为:CO32-+2H+=CO2↑+H2O、OH-+H+=H2O,故答案为:CO32-+2H+=CO2↑+H2O、OH-+H+=H2O;
(3)对溶液Ⅱ处理得到晶体时,需要蒸发结晶操作,所必须使用到的玻璃仪器有蒸发皿、玻璃棒2种,故答案为:2;
(4)加入Na2CO3后与HCl反应也得到了一定量的NaCl,故制得的纯品中NaCl的质量应比粗盐中NaCl的质量要大,故答案为:否;加入Na2CO3后与HCl反应也得到了一定量的NaCl,故制得的纯品中NaCl的质量应比粗盐中NaCl的质量要大.
点评 本题考查了物质的除杂和有关溶液的计算和配制,难度比较大,特别的除去食盐中的多种杂质,要根据除杂的原理深入思考,按照最优化的顺序添加除杂剂.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 大气中的含量 (体积百分比) | 温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
 配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.
配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com