
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 58.5gNaCl溶解于1L水中配成的溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将22.4L的HCl气体溶于水,制成1L溶液,其浓度为1mol/L | |
| C. | 配制480ml 1.0mol/L的NaOH 溶液需要NaOH 固体20.0g | |
| D. | 中和100ml 1 1mol/L 的H2SO4溶液,需要NaOH 4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
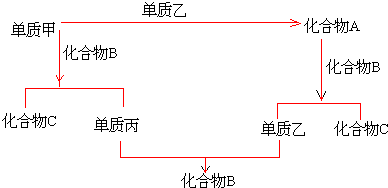
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL0.1mol•L-1HAc与中和100mL0.01mol•L-1HAc所需NaOH的物质的量不同 | |
| B. | 10mL0.1mol•L-1氨水与100mL0.01mol•L-1氨水,其OH-物质的量相同 | |
| C. | 相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大 | |
| D. | 锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
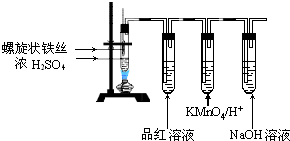
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L NH3中含氮原子数为 NA | |
| B. | 1 mol Na2O2与水完全反应时转移的电子数为NA | |
| C. | 100 mL 2.0 mol•L-1 NH4HCO3溶液中NH4+数为0.2NA | |
| D. | 1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
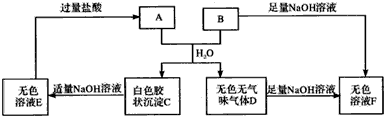
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
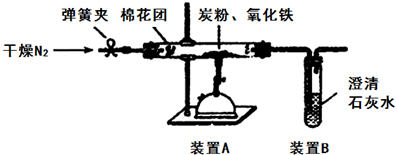
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com