
下列事实可以证明MOH是弱碱的有
①0.1mol/LMOH溶液能使酚酞溶液变红
②常温下,0.1mol/LMOH溶液的pH=12
③0.1mol/LMOH溶液的导电性比0.1mol/LNaOH溶液弱
④等体积的0.1mol/LMOH溶液与0.1mol/LHCl溶液恰好完全反应
A.①②③ B.②③ C②④ D③④
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:填空题
工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g) CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为____________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是____________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度____________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为____________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是____________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度____________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是____________(填字母序号)。
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 时数据 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=________;a1+a3________1(填“<”、“>”或“=”,)。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上学期期中化学试卷(解析版) 题型:实验题
硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +__________+H2O;双氧水的作用是 。
(2)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(3)将滤液B通过 、 ,过滤,洗涤等操作可得到硫酸铜晶体。
(4)硫酸铜也可以用硫化铜和氧气在高温 条件下化合制得,该反应的化学方程式 。
条件下化合制得,该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:填空题
如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。丙池中盛有100 mL 3.00 mol.L-1的CuSO4溶液。试回答下列问题:
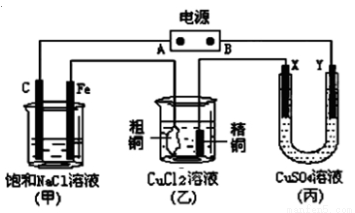
(1)在电源中,B电极为 极(填电极名称,下同);乙装置中粗铜为 极。
(2)在甲装置中,石墨(C)电极上发生 反应(填“氧化”或“还原”);甲装置中总的化学方程式是 。
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为 L。
(4)在丙装置中, X电极上发生的电极反应式是 。
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了 g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
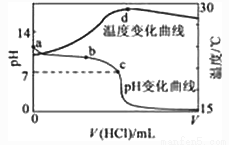
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c( NH3·H2O) >c(Cl-)
NH3·H2O) >c(Cl-)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是
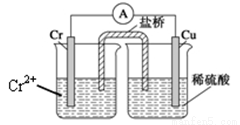
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论 上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项
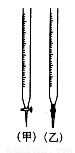
锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
将固体NH4I置于密闭容器中,某温度下发生下列反应 NH4I(s)  NH3(g) + HI(g),2HI(g)
NH3(g) + HI(g),2HI(g)  H2(g) + I2(g)。当反应达到平衡时,c(H2)=0.5mol·L-1 ,c(HI)=4mol·L-1 ,则NH3(g)的浓度是( )mol·L-1 。
H2(g) + I2(g)。当反应达到平衡时,c(H2)=0.5mol·L-1 ,c(HI)=4mol·L-1 ,则NH3(g)的浓度是( )mol·L-1 。
A. 5 B.4 C.4.5 D.3.5
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考四化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值,下列说法正确的是
A.常温常压 下,32gO2 、O3的混合物含有2Na个氧原子
下,32gO2 、O3的混合物含有2Na个氧原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.1L1mol/L的盐酸溶液中含HCl分子数为1NA
D.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com