
| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
 .
. .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.分析 由于A的最高正价为+2,无最低负价,故和铍同一主族,故为Mg;B的最高正价为+3价,且半径比Mg小,比铍大,故为Al;C的最高正价为+5价,最低负价为-3价,且半径比铍还小,故为第二周期的N;D的最低负价为-2价,无最高正价,且半径比铍小,故为O;E的最高正价为+6,最低负价为-2价,故和O同为第VIA族,故为S;F的最高正价为+7,最低负价为-1价,故为第VIIA族,且由于原子半径比铍大,故为Cl.
(1)根据A为Mg、C为N、D为O、F为Cl来分析在周期表中的位置;
(2)A为Mg,原子核外有3个电子层,最外层有2个电子;
(3)D离子为O2-,核外有10个电子,核内有8个质子;
(4)元素的非金属性越强,则最高价含氧酸的酸性越强;
(5)C元素气态氢化物为NH3,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,硝酸铵为离子化合物,结构中含离子键和共价键;
(6)B的最高价氧化物的水化物为氢氧化铝,E的最高价氧化物的水化物为硫酸,两者发生酸碱中和;
(7)同一周期的元素从左到右,非金属性逐渐增强,且非金属性越强,单质和氢气化合越容易,得到的气态氢化物越稳定,据此分析.
解答 解:由于A的最高正价为+2,无最低负价,故和铍同一主族,故为Mg;B的最高正价为+3价,且半径比Mg小,比铍大,故为Al;C的最高正价为+5价,最低负价为-3价,且半径比铍还小,故为第二周期的N;D的最低负价为-2价,无最高正价,且半径比铍小,故为O;E的最高正价为+6,最低负价为-2价,故和O同为第VIA族,故为S;F的最高正价为+7,最低负价为-1价,故为第VIIA族,且由于原子半径比铍大,故为Cl.
(1)由于A为Mg,处于第三周期、第IIA族;C为N,处于第二周期第VA族;D为O,处于第二周期第VIA族;F为Cl,处于第三周期第VIIA族,故可标出其在周期表中的位置,故答案为:
| N | O | ||||||||||||||||
| Mg | Cl | ||||||||||||||||
 ,故答案为:
,故答案为: ;
; ,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为:
,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为: ;离子;离子键、共价键;
;离子;离子键、共价键;点评 本题考查学生元素周期表中元素分布以及元素周期律的知识,可以根据所学知识来回答,难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
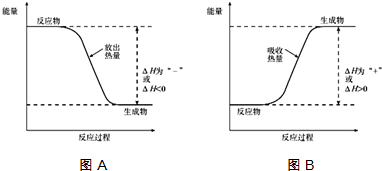
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
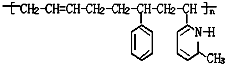 新弹性材料丁基苯呲橡胶可通过加聚反应得到,其结构简式如图,其单体可能是以下物质中的某几种,则正确的一组单体是( )
新弹性材料丁基苯呲橡胶可通过加聚反应得到,其结构简式如图,其单体可能是以下物质中的某几种,则正确的一组单体是( )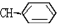
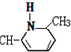
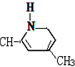
| A. | ①②⑥ | B. | ②③⑤ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl(NH4Cl)用加热法分离 | B. | CO2(SO2)通过饱和的碳酸钠溶液洗气 | ||
| C. | NO(NO2)通过水洗气 | D. | FeCl3溶液(FeCl2)通入氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水 | B. | 盐酸酸化的Ba(NO3)2溶液 | ||
| C. | BaCl2溶液 | D. | BaCl2与NaOH的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 NaOH H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(B2)=0.8 mol/(L•s) | B. | V(A2)=0.8 mol/(L•s) | ||
| C. | V(C)=0.6 mol/(L•s) | D. | V(A2)=1.8 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ SO2 | B. | 4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2 | ||
| C. | 2SO2+O2 $?_{加热}^{催化剂}$ 2SO3 | D. | SO3+H2O=H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com