
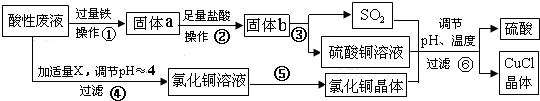
分析 从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜,向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,酸性废液调节pH值使铁离子沉淀,过滤得氯化铜溶液,氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸,硫酸可以再循环利用,
(1)步骤②中从溶液中分离出固体物质过量的铁和生成的铜;
(2)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,据此确定所加物质X;
(3)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体;
(4)根据流程分析可知,硫酸可以循环利用,根据反应中硫元素守恒判断是否需要补充硫酸;
(5)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀.
解答 解:(1)步骤②中从溶液中分离出固体物质过量的铁和生成的铜,所以步骤②的操作名称是过滤、洗涤,
故答案为:过滤、洗涤;
(2)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,所以物质X为CuO或Cu (OH)2或CuCO3等,
故答案为:CuO或Cu (OH)2或CuCO3等;
(3)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体,减少CuCl的损失,
故答案为:减少CuCl的损失;
(4)根据流程分析可知,硫酸可以循环利用,Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4,
故答案为:否;
(5)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀,电极反应式为 Cu2++Cl-+e-=CuCl↓,
故答案为:Cu2++Cl-+e-=CuCl↓.
点评 本题考查了CuCl的生产工艺流程,为高考热点和难点,涉及物质的分离、物质的制备,明确物质的性质是解题关键,注意物质性质的理解应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的电子数为17NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48g O3所含的氧原子数为3NA | |
| D. | 1 mol/L NaCl溶液中所含的Na+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的沸点高于CH4,推测HCl的沸点高于HF | |
| B. | Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu | |
| C. | 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg | |
| D. | CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中1 mol金属镁变成镁离子时失去电子的数目为2NA | |
| B. | 28 g氮气所含有的原子数目为NA | |
| C. | 标准状况下,22.4 L水中含有NA个水分子 | |
| D. | 标准状况下,22.4 L氯化氢所含的原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com