
【题目】配制500 mL0.5mol/LNaOH溶液,试回答下列问题:
(1)需要称取NaOH固体的质量为___;
(2)配制方法:设计五个操作步骤,请在横线上填上合适的仪器名称
①向盛有NaOH的烧杯中加入100mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿___注入___中。
③在烧杯中加入少量的蒸馏水,小心洗涤___2~3次并把每次的洗涤液都转移入___。
④继续往___中加蒸馏水至液面接近刻度线1~2cm。
⑤改用___滴加蒸馏水至刻度线,盖好摇匀。
(3)以下操作会使实际配制NaOH溶液的浓度偏低的有___。
A.定容时俯视刻度线 B.溶解后的烧杯未经洗涤
C.称量用的烧杯不干燥 D.容量瓶中原来存有少量蒸馏水
【答案】10.0g 玻璃棒 500mL容量瓶 烧杯和玻璃棒 500mL容量瓶 500mL容量瓶 胶头滴管 B
【解析】
(1)计算出氢氧化钠的物质的量,再求出氢氧化钠的质量;
(2)②用玻璃棒引流到容量瓶中,注意容量瓶的容积;
③必须对烧杯和玻璃棒碱性洗涤;洗涤液转移到容量瓶中;
④向容量瓶中继续加蒸馏水;
⑤用胶头滴管定容;
(3)根据c=![]() 分析误差。
分析误差。
(1)需要氢氧化钠的物质的量是:0.5mol/L×0.5L=0.25mol,氢氧化钠的质量为:40g/mol×0.25mol=10.0g;
(2)②将NaOH溶液沿着玻璃棒引流到500mL容量瓶中;
③转移完烧杯中溶解的溶液后,必须对烧杯和玻璃棒减小洗涤,洗涤后的溶液也要转移到500mL容量瓶中;
④再继续向500mL容量瓶中加蒸馏水,至液面接近刻度线1~2cm;
⑤定容时用胶头滴管定容;
(3)A.定容时俯视刻度线,会导致配制的溶液的体积偏小,浓度偏高,故A错误;
B.溶解后的烧杯未经洗涤,导致配制的溶液中溶质的物质的量偏小,浓度偏小,故B正确;
C、称量氢氧化钠利用的是总质量和小烧杯的质量差,所以称量用的烧杯不干燥,不影响结果,故C错误;
D.容量瓶中有水,不影响配制结果,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型HIN1等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO,1000 mL,密度1.192g/cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)100g某84消毒液与3.55g氯气的氧化能力相当,该产品的有效氯就是3.55%。请问100g某84消毒液中含有___gNaClO。
(2)一瓶“威露士”牌“84消毒液”最多能吸收空气中CO2___L(标准状况)而变质。
(3)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是___(填编号)。
A.如图所示的仪器中,有四种是不需要的,还需两种玻璃仪器
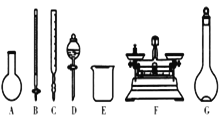
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
(4)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为___g。

(5)配制一定物质的量浓度的盐酸溶液,下列操作导致所配制的稀盐酸物质的量浓度偏低的是___(填字母)。
A.未恢复到室温就将溶液注入容量瓶并进行定容
B.用量筒量取浓盐酸时俯视凹液面
C.容量瓶用蒸馏水洗后未干燥
D.未洗涤烧杯和玻璃棒
E.定容时仰视液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
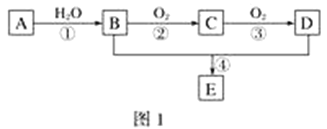
(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。
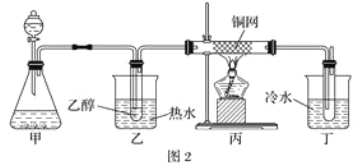
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂。隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用如图所示部分装置迸行实验(夹持装备略)

实验I验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
(1)所选用装置的正确连接顺序为___(填装置的字母序号)。
(2)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:___。
实验Ⅱ探究分解产物中的硫氧化物,连接装置AEFB进行实验。
(3)实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是___。
(4)实验证明(NH4)2Fe(SO4)2受热分解除生成上述产物外,还有N2产生,写出A中反应的化学方程式___。
Ⅲ、为测定硫酸亚铁铵(NH4)2Fe(SO4)26H2O晶体纯度,某学生取mg硫酸亚铁铵样品配成500mL溶液,根据物质组成,设计了如下三个实验方案,请回答:
方案一:取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
方案二:取20.00mL硫酸亚铁铵溶液进行如下实验。

方案三:(通过NH4+测定)实验设计如图所示。取20.00mL硫酸亚铁铵溶液进行该实验。

(5)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因是___。
(6)方案三选择装置___(填图一或图二)较为合理,判断理由是___。若测得NH3的体积为VL(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为___(列出计算式即可,不用简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
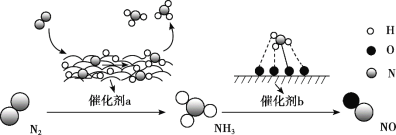
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。
![]()
(1)该小组同学欲用图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。

① 应该选择的仪器是__________(填字母)。
② 将各仪器按先后顺序连接起来,应该是a接__________,__________接__________,__________接__________,__________接h(用导管口处的字母表示)。
③ 浓盐酸与二氧化锰反应的离子方程式为__________。
(2)该小组同学设计分别利用图所示装置探究氯气的氧化性。
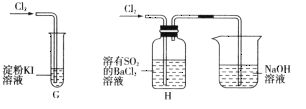
①G中的现象是__________,原因是__________(用化学方程式表示)。
②H中的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表中的短周期元素,它们的相对位置如下表所示,其中X、Y 元素均能形成10电子的氢化物,Z的原子序数是Y的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)W的简单离子的结构示意图为______,Y元素在周期表中的位置是____。
(2)写出实验室制W元素单质的离子方程式:___________
(3)关于W同主族元素,下列说法正确的是:__________
A.从上到下密度逐渐增大
B.从上到下熔点和沸点都逐渐升高
C.从上到下元素的非金属性越来越强
D.同主族元素对应的单质中,只有W元素对应的单质在常态下为气态
(4)W与Z形成的液体化合物Z2W2,该物质可与水反应生成ZO2气体,1 mol Z2W2参加反应时转移1.5 mol电子,其中只有一种元素化合价发生改变,Z2W2与水反应的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com