
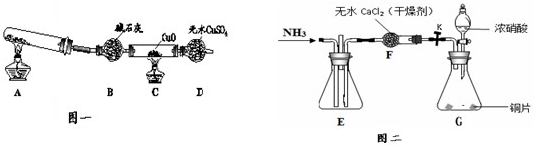
 如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.
如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.| V |
| Vm |
| 0.672L |
| 22.4L/mol |
| ||
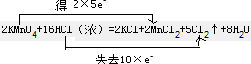 ;
; .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、空气(混合物)、C2H5OH(有机物)、H2SO4(化合物)、CO2(电解质) |
| B、液氨(非电解质)、NH4Cl(盐)、HNO3(含氧酸)、NaOH(强电解质) |
| C、HCl(化合物)、NaHCO3(酸)、Na2O2(碱性氧化物)、CCl4(电解质) |
| D、SO2(酸性氧化物)、CuSO4?5H2O(混合物)、CaO(碱性氧化物)BaCO3(电解质) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠与盐酸;氢氧化钠与醋酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D、石灰石与硝酸;碳酸钙与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| A、在①、②中分别加入氯化铵固体,两溶液的 pH均增大 |
| B、分别将等体积的①和②加水稀释m倍和n倍后,pH仍相同,则:m>n |
| C、把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、将溶液②和溶液③等体积混合,混合后所得溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的溶液一定呈酸性 |
| B、25℃时,pH=7的一定是纯水 |
| C、溶于水呈中性的盐一定未发生水解 |
| D、酸碱恰好中和时,溶液不一定为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 氧气中含有6.02×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1 mol/L的硫酸和盐酸,电离出的氢离子数之比为2:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com