
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
分析 X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,则Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,平均原子序数为12,则X为Na、Z为O,X、Y、Z的原子序数之和为36,Y的原子序数为36-11-8=17,可知Y为Cl,然后结合元素周期律的递变规律解答该题.
解答 解:X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,则Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,平均原子序数为12,则X为Na、Z为O,X、Y、Z的原子序数之和为36,Y的原子序数为36-11-8=17,可知Y为Cl,
A.X为Na,同周期中金属性最强,故A正确;
B.具有相同的核外电子层结构的离子,核电核数越大,半径越小,则离子半径应为:Z2->X+,而原子半径为X>Y,故B错误;
C.同主族从上到下非金属性减弱,非金属性越强对应氢化物越稳定,则主族元素中Z的氢化物稳定性最高,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,Y的最高价氧化物对应水化物为高氯酸,酸性最强,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意周期律的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
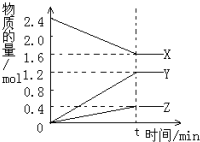 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g•L-1 |
| 排放标准 | pH 6~9 | 0.5mg•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
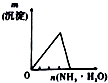 | 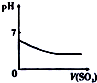 | 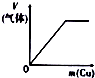 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):水、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合气体的平均相对分子质量$\overline{M}$不再随时间变化的反应达到平衡状态 | |
| B. | 15.0℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3 | |
| C. | 该反应△H>0,p2=2p1 | |
| D. | 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com