
| A. | 溶液中c(B-)为1.6×10-3mol/L | |
| B. | 溶液中c(B-)为1.7×10-13mol/L | |
| C. | AB2比AC更难溶解 | |
| D. | 因两者不同类而无法比较其溶解度的大小 |
分析 AB、依据Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15,分别列出其表达式,利用c(C2-)=1.8×10-13 mol/L计算即可;
CD、AB2、AC两者Ksp(AB2)=c(A2+)×c2(B-),Ksp(AC)=c(A2+)×c(C2-),两者不类似,不能比较溶解度的大小.
解答 解:A、已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15.在AB2、AC均为饱和的混合液中,Ksp(AB2)=c(A2+)×c2(B-)=4.2×10-8,Ksp(AC)=c(A2+)×c(C2-)=3.0×10-15.得到,Ksp(AB2):Ksp(AC)=c(A2+)×c2(B-):c(A2+)×c(C2-)=4.2×10-8:3.0×10-15 测得c(C2-)=1.8×10-13 mol•L-1,则c(B-)=1.6×10-3 mol/L,故A正确;
B、依据A的计算c(B-)=1.6×10-3 mol/L,故B错误;
C、AB2与AC的Ksp表达式不相似,无法比价其溶解度大小,故C错误;
D、AB2与AC的Ksp表达式不相似,无法比价其溶解度大小,故D正确,
故选AD.
点评 本题主要考查的是沉淀溶解平衡和溶度积常数的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
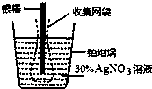 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )| A. | 电量计工作时溶液里的阴离子向正极移动 | |
| B. | 电量计工作时银棒应与电源的正极相连 | |
| C. | 网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏低 | |
| D. | 若得金属银的沉积量为1.08g,则电解过程中转移的电子为0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
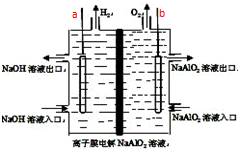 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
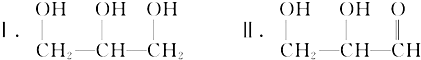
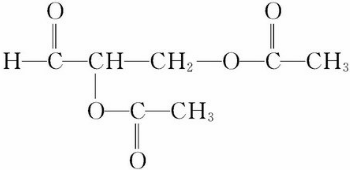 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | |
| 取少量溶液于试管A中,加入足量的1mol•L-1H2SO4 | 溶液呈蓝色 | 溶液中含IO3- |
| 另取少量溶液于试管B中,滴入几滴酚酞溶液 | 溶液变红 | 溶液中含大量OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
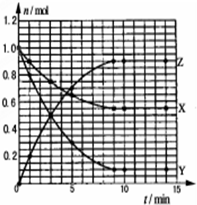 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )| A. | 反应的化学方程式是X+2Y?2Z | |
| B. | 该反应在0-3min时间内产物Z的平均反应速率0.083mol•L-1•min-1 | |
| C. | 由图象知该反应吸收能量 | |
| D. | 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 常温常压下,30g甲醛所含有的原子数目为4NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤块粉碎后燃烧 | |
| B. | 用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 | |
| C. | 将食物贮藏在冰箱中 | |
| D. | 用双氧水溶液制氧气时添加少量二氧化锰粉末 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com