
分析 (1)NaHCO3是强碱弱酸酸式盐,HCO3-水解程度大于其电离程度导致溶液呈碱性,但其水解、电离程度都较小;
(2)溶液中存在电荷守恒,根据电荷守恒判断;
(3)溶液中Na元素和C元素之间存在物料守恒,溶液中存在含有C元素的微粒有H2CO3、HCO3-、CO32-;
(4)溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒确定c(OH-).
c(H+)+c(H2CO3)=c(OH-)+c(HCO32-)
解答 解:(1)NaHCO3在溶液中存在水解和电离,水解程度大于电离程度,溶液显碱性,c(OH-)>c(H+),钠离子不水解,HCO3-电离和水电离都生成H+,所以离子浓度关系为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),
故答案为:c(HCO3-)+c(OH-)+2c(CO32-);
(3)根据碳酸氢钠溶液的物料守恒可得:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),
故答案为:c(HCO3-)+c(CO32-)+c(H2CO3);
(4)溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),根据物料守恒可得:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),
所以得c(H+)+c(H2CO3)=c(OH-)+c(HCO32-),故答案为:c(H+)+c(H2CO3)=c(OH-)+c(HCO32-).
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确盐类水解原理及溶液中存在的电荷守恒、物料守恒是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| B. | 放电过程中,b电极附近溶液的pH减小 | |
| C. | 电池工作时,Na+从b极区移向a极区 | |
| D. | 若用该电池电解饱和食盐水,转移2 mole-时,阴极析出46gNa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Y | Q | ||||
| X | Z |
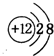 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用氢氧化钠溶液收集产物 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g氮气所含质子数目为7 NA | |
| B. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| C. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.2NA | |
| D. | 1molNa2O2中离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的最简式为CH | |
| B. | 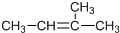 名称为顺-2甲基2丁烯 名称为顺-2甲基2丁烯 | |
| C. | 四氯化碳的电子式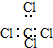 | |
| D. | 1,2-二溴乙烷的结构简式为C2H4Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com