
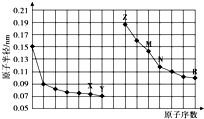
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,
A.同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,所以碱性强弱为:Z>M,故A错误;
B.HF含有氢键,沸点较高,则沸点大小为:Y>R,故B错误;
C.X、N两种元素组成的化合物为二氧化硅,可与HF酸反应,故C错误;
D.离子电子层结构相同,核电荷数越大离子半径越小,所以简单离子的半径:Z<X<R,故D正确;
故选D.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,审题中要抓住“短周期元素”几个字,试题培养了学生的灵活应用能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
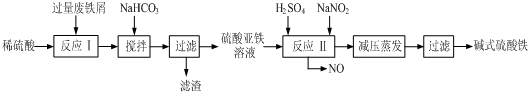
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.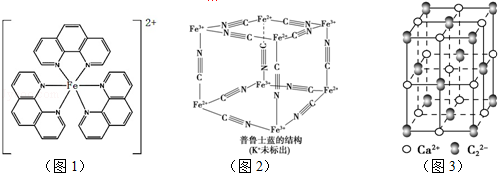
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
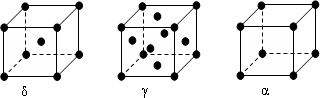
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
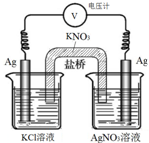 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com