
【题目】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察_______________________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是___________________________。
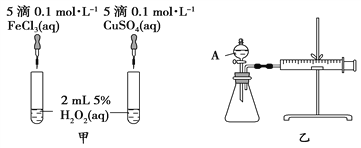
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看_____________________,实验中需要测量的数据是__________________________。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

由D到A过程中,随着反应的进行反应速率逐渐_________。(填 “加快”或“减慢”),其变化的原因是_____________。(选填字母编号)
A.改变了反应的活化能 B.改变活化分子百分比
C.改变了反应途径 D.改变单位体积内的分子总数
(4)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和弱酸草酸反应的离子方程式为_________________________________________,反应开始一段时间后反应速率明显提升的原因是_______________________________。
【答案】 产生气泡的快慢 阴离子相同更能说明铁离子和铜离子的催化效果 分液漏斗 注射器活塞是否复原 生成40mL气体所需要的时间 减慢 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 反应生成锰离子起催化作用
【解析】(1)由于反应中产生氧气,因此利用甲实验,可以通过观察H2O2溶液产生气泡的快慢,从而定性比较Fe3+、Cu2+的催化作用强弱;有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是可以消除阴离子不同对实验的干扰;(2)若利用乙实验可进行定量分析,图中仪器A的名称为分液漏斗,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是产生40 mL气体所需的时间;由于装置中有注射器,因此检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看到注射器活塞是否复原,说明装置不漏气;(3)由图线可知,随着反应的进行,反应物的浓度不断减小,即单位体积内的分子总数逐渐减小,所以反应速率逐渐减慢,答案选D;(4)根据电子得失守恒和原子守恒可知酸性高锰酸钾和弱酸草酸反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,反应开始一段时间后反应速率明显提升的原因可能是生成的锰离子起催化作用。


科目:高中化学 来源: 题型:
【题目】(1)双氧水能使酸性高锰酸钾溶液褪色,其反应的化学方程式如下,请将相关的化学计量数填写在方框里:_______□H2O2+□KMnO4+□H2SO4=□MnSO4+□K2SO4+□O2↑+□H2O
(2)某混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、Br-、CO32-、AlO2- |
为探究其成分,进行了以下探究实验。
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠的体积(V)的关系如图所示。

①该溶液中一定含有的阳离子是____________,其对应的物质的量浓度之比为_________,一定不存在的阴离子是______________;
②请写出沉淀减少过程中发生反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=242kJ·mol1
O2(g)= H2O(g) ΔH3=242kJ·mol1
反应①的ΔH1为________kJ·mol1。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是_______________________________。
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是_____________,每生成l mol Na2FeO4转移________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 质子数相同的原子,其核外电子排布也相同
B. 质量数相同的原子,其化学性质一定相同
C. 金属性越活泼,其原子在反应中越易失去电子
D. 非金属性越活泼,其阴离子越难失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,能直接表示出氯化钠晶格能的是( )
A.Na+(g)+Cl-(g)===NaCl(s) ΔH1B.Na(s)+Cl(g)===NaCl(s) ΔH2
C.Na+(g)+Cl-(g)===NaCl(g) ΔH3D.Na(g)+Cl(g)===NaCl(s) ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中每个水分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中只存在范德华力不存在氢键,一个分子周围有12个紧邻的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)拆开1 mol H-H键、1 mol N-H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2生成NH3的反应热为__________,1 mol H2生成NH3的反应热为__________。
(2) 写出298 K 101 kPa时,用CO(g)还原1 mol Fe2O3(s),放热24.8 kJ的热化学方程式:________________________________________________________。
(3) 已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1,
N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式及反应类型均正确的是
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2 CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com