
如图所示的实验中,投入铝片后
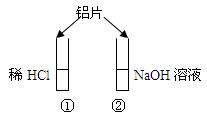
A.①中产生气泡,②中不产生气泡
B.①和②中都不产生气泡
C.①和②中都产生气泡,①中是H2,②中是O2
D.①和②中都产生气泡,且都是H2
科目:高中化学 来源: 题型:
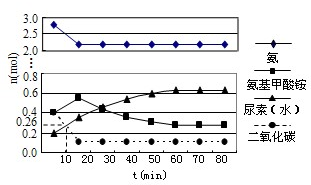
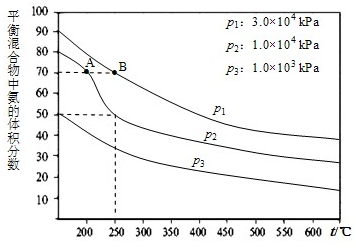 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.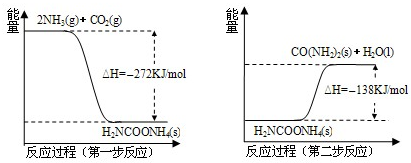
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
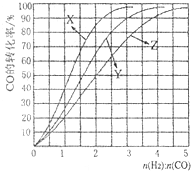 工业上常利用CO和H2合成可再生能源甲醇.
工业上常利用CO和H2合成可再生能源甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
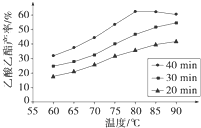 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是___________。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
方法 | 需测定的数据 |
① | 测定产生的H2的体积 |
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:___________________。
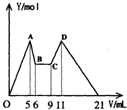
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加amL c1 mol·L-1NaOH之后,改成滴加c2mol·L-1 HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示。据此,回答下列问题:

(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则c1/c2=__________;
(2)所加入NaOH溶液的体积a=________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com