
【题目】高锰酸钾在化学实验中是一种常用的氧化剂,某化学兴趣小组拟在实验室制备KMnO4并测定其纯度。
Ⅰ.KMnO4的制备
步骤1:利用下图所示装置制备K2MnO4
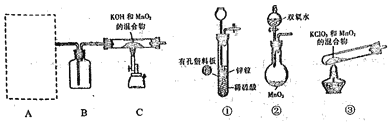
(1)装置A应选用_______( 填"①","②"或"③"),装置B中盛装的试剂是_______。
(2)装置C中反应生成K2MnO4的化学方程式为_________。
步骤2:由K2MnO4制备KMnO4
已知:①3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
②相关物质的溶解度数据见下表:

实验流程如下:
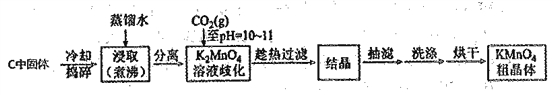
(3)结合相关物质的化学性质及溶解度,可以替代CO2的试剂是______________。
A.亚硫酸氢钾 B.稀硫酸 C.稀盐酸 D.稀醋酸
(4)当溶液pH达10~11时,停止通CO2;若CO2过量,会因生成____而使其和产品一起析出
(5)证明K2MnO4歧化完全的方法:取上层清液少许于试管中,通入CO2,若________,证明K2MnO4歧化完全。
Ⅱ.KMnO4纯度的测定
(6)通过用草酸(二元弱酸)滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中发生反应的离子方程式为__________________。
②称取 w g KMnO4粗产品配制100mL待测溶液,量取KMnO4待测液10.00mL于锥形瓶中进行实验,进行三次平行实验后测得平均消耗c mol/L草酸标准液V mL,则样品纯度的表达式为___________。
【答案】 ② 浓硫酸 4KOH+2MnO2+O2![]() 2K2MnO4+2H2O D KHCO3 若无黑色沉淀产生 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 158cV/(250W)×100%
2K2MnO4+2H2O D KHCO3 若无黑色沉淀产生 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 158cV/(250W)×100%
【解析】Ⅰ(1)由实验目的和图中信息可知,装置A应为制备氧气的装置,故装置A应选用②(装置③是错的,给固体加热的试管口要稍向下倾斜),装置B是干燥氧气的,其中盛装的试剂是浓硫酸。
(2)装置C中反应生成K2MnO4的化学方程式为4KOH+2MnO2+O2![]() 2K2MnO4+2H2O。
2K2MnO4+2H2O。
(3) K2MnO4溶液中加入酸节pH后发生歧化反应生成高锰酸钾,根据生成物溶解度选择可以代替碳酸的是稀醋酸,选D。
(4)当溶液pH达10~11时,停止通CO2,若CO2过量,会因生成KHCO3而使其和产品一起析出
(5)证明K2MnO4歧化完全的方法:取上层清液少许于试管中,通入CO2,若若无黑色沉淀产生,证明K2MnO4歧化完全。
Ⅱ. (6)①滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
②称取 w g KMnO4粗产品配制100mL待测溶液,量取KMnO4待测液10.00mL于锥形瓶中进行实验,进行三次平行实验后测得平均消耗c mol/L草酸标准液V mL,由上述离子方程式可知,n(KMnO4)= ![]() n(H2C2O4)=
n(H2C2O4)= ![]() L
L![]() c mol/L=4Vc
c mol/L=4Vc![]() mol,则样品纯度的表达式为
mol,则样品纯度的表达式为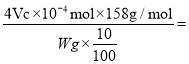 158cV/(250W)×100%。
158cV/(250W)×100%。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A. 该温度高于25℃
B. 由水电离出来的H+的浓度是1.0×10-10mol·L-1
C. NaHSO4晶体的加入抑制了水的电离
D. 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。有机物为C6H12O6)。下列说法正确的是

A. A为正极,H2PCA在该电极上发生氧化反应
B. 放电过程中,正极反应为2H2O-4e=4H++O2↑
C. 若1molO2参与电极反应,有2 mol H+穿过质子交换膜进入右室
D. 电池总反应为:C6H12O6+6O2![]() 6CO2↑+6H2O
6CO2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇和乙酸是比较常见的有机物。
(1)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为_______________(不用写反应条件)。
(2)乙醇能够发生氧化反应:乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_______。
(3)下列关于乙醇的说法正确的是______(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.乙醇只能被氧化成乙醛
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
(4)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
增大,应加入的物质或采取的措施是
①NH4Cl固体,②硫酸,③NaOH固体,④水,⑤加热,⑥加入少量MgSO4固体
A、①②③⑤ B、③ C、③⑥ D、③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝能提炼难熔金属和制成铝热剂,是因为铝( )
A.密度小,熔点较低
B.具有还原性,且生成氧化铝时放出大量热
C.在空气中燃烧,发出耀眼白光
D.是金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.1 mol/L的盐酸(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:
(1)三种酸的氢离子浓度由大到小的顺序是_________;三种酸的pH由大到小的顺序是______(填字母代号,下同)。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是____________(不考虑Zn的纯度及表面积等问题)。
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是__________________。
(4)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.5 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL、0.5 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL(保留1位小数),现有
①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________________________________________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→________→ ________→________→________→④(填序号)。_________
(5)在配制过程中,其他操作都准确,下列操作中错误的是________(填代号,下同),能引起误差偏高的有________。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修5:有机化学基础】
聚碳酸酯(PC)是一种强韧的热塑性树脂,广泛用于玻璃装配业、汽车工业、电子和电器工业。PC的一种合成路径如下:
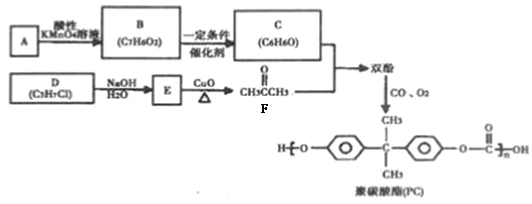
回答下列问题:
(1)烃A 的质谱图如下,则A 的分子式为__________。
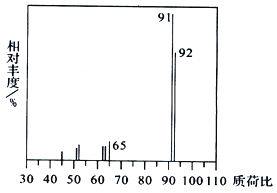
(2)D 的名称为_________,D→E的反应类型为_______。
(3)双酚的结构简式为_______。
(4)B 和E 可以形成一种酯类物质F,写出B + E→F反应的化学方程式:_______。
(5)F的同分异构体中,能同时满足如下条件的共有______种(不考虑立体异构)。
① 分子中有两个甲基;
② 能发生银镜反应;
③ 在酸性溶液中的水解产物遇FeC13 溶液显紫色。
写出其中核磁共振氢谱显示5组峰,且峰面积比为62:2:11的种分子的结构简式:_______。
(6)写出由D分子合成甘油(丙三醇)的合成路线图_______。(已知:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com