
 用标签如图的浓硫酸配得200mL某浓度的稀硫酸,现将27.2g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)
用标签如图的浓硫酸配得200mL某浓度的稀硫酸,现将27.2g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)| 103ρw |
| M |
| n |
| c |
| 2.24L |
| 22.4L/mol |
| 103ρw |
| M |
| 103×1.84×98% |
| 98 |
|
|
| 0.4mol |
| 18.4mol/L |
| 0.4mol |
| 0.2L |


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
| A、多饮纯净水 |
| B、在牙膏中添加适量的Ca2+或PO43-离子 |
| C、在饮用水中加入柠檬片 |
| D、在牙膏中加入适量的氟化物添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
| C、Cl2与水反应 Cl2+H2O═Cl-+ClO-+2H+ |
| D、F2与NaOH溶液反应 2F2+4OH-═4F-+O2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、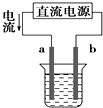 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 把18.0mol/L 的浓硫酸稀释成1.80mol/L 的稀硫酸100mL,实验操作如下:
把18.0mol/L 的浓硫酸稀释成1.80mol/L 的稀硫酸100mL,实验操作如下:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验结论 |
(1)A的质谱图: |
(1)证明A的相对分子质量为: |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: |
| (3)另取两份9.0g A分置于不同的试管中. 往其中一份A中加入足量的NaHCO3粉末充分反应,生成 |
(3)证明A的分子中含有一个羧基和一个羟基. |
(4)A的核磁共振氢谱如图: |
(4)A的结构简式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 |
| B、稀醋酸与0.1mol?L-1NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=57.3kJ?mol-1 |
| C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1 |
| D、已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com