
| 25.6g |
| 64g/mol |
| 0.4mol×2 |
| 2×(2-0) |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
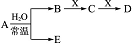 已知由 C、N、O、Na、Fe五种元素组成的常见单质或化合物存在如图所示转化关系(部分生成物和反应条件略去).
已知由 C、N、O、Na、Fe五种元素组成的常见单质或化合物存在如图所示转化关系(部分生成物和反应条件略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:1 | B、18:7 |
| C、41:9 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl难溶于水,溶液中没有Ag+和Cl- |
| B、AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| C、向AgCl溶液中加入盐酸,一定会有沉淀生成 |
| D、向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、.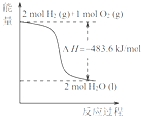 热化学方程式是H2(g)+
| ||
B、.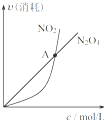 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | ||
C、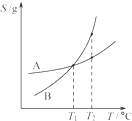 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | ||
D、.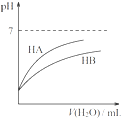 同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温下,22.4L氧气所含的分子总数为NA |
| B、在标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1 |
| C、标准准况下,22.4L 乙醇中含有NA个乙醇分子 |
| D、在1L 0.1mol/L的碳酸钠溶液中,所含Na+的数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com