
【题目】常温下,向10mL0.1 mol/L CuCl2溶液中滴加0.1 mol/L Na2S溶液滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法错误的是

A. Ksp(CuS)的数量级为10-35
B. 曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS)
C. a、b、c三点中,由水电离的c(H+)和c(OH-)的积最小的为b点
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
【答案】A
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-=CuS↓,Cu2+或S2-均会水解,水解促进水的电离,结合图象中横坐标、纵坐标的含义和溶液中的守恒思想,计算溶度积常数。
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-=CuS↓,Cu2+或S2-均会水解,水解促进水的电离,b点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)![]() Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L。
Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L。
A.平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS) =c(S2-)·c(Cu2+)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,由于已知lg2=0.3,则Ksp(CuS) =10-35.4mol2/L2=(100.3)2×10-36mol2/L2=4×10-36 mol2/L2,A错误;
B.向含有Cu2+的溶液中加入Na2S溶液,Cu2+与S2-发生沉淀反应:Cu2++S2-=CuS↓,加入Na2S溶液的体积越大,c(S2-)越大,c(Cu2+)越小,则-lgc(Cu2+)就越大,由于温度不变,所以曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS),B正确;
C. a点Cu2+过量、c点S2-过量,b点恰好完全反应生成CuS和NaCl,a点溶液中Cu2+浓度远大于b点,c点溶液中S2-浓度远大于b点,Cu2+、S2-水解促进水的电离,根据浓度对水解平衡的影响,则b点水电离的c(H+)和c(OH-)的积最小,C正确;
D.C点为Na2S、NaCl按1:2物质的量混合溶液,其中CuS处于沉淀溶解平衡状态,根据物料守恒及物质的溶解性,可知c(Na+)>c(Cl-)>c(S2-),S2-水解消耗水电离产生H+,使溶液中c(OH-)>c(H+),但水电离产生的离子浓度远小于盐电离产生的离子浓度,故c(S2-)>c(OH-),因此该溶液中微粒浓度大小关系为:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),D正确;
故合理选项是A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.NA个H+的质量为1g
B.1mol氩气分子的原子数目为2NA
C.标况下,NA个四氯化碳分子的体积为22.4L
D.1mol/L的蔗糖水溶液中含蔗糖分子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分Ca(OH)2,含Fe2O3、MgO和SiO2等杂质]为原料制备纳米碳酸钙的一种工艺流程如下:


(1)“浸渍”时,NH4Cl和Ca(OH)2反应的化学方程式为________________________________________。
(2)“浸渍”时,一定时间内Ca2+浸取率随温度变化如图所示。Ca2+浸取率随温度升高而上升的两个原因是_________________________________________;__________________________________________。
(3) “碳化”时,一般采用低温工艺,对应的离子方程式为___________________________。
(4)滤液Ⅱ中,可循环利用的溶质的化学式为___________________________________。
(5)“洗涤”时,检验是否洗净的方法是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >H2CO3>
>H2CO3>![]() ,将
,将 转变为
转变为![]() 的方法是 ( )
的方法是 ( )
A. 与足量的NaOH溶液共热,再通入SO2
B. 与稀H2SO4共热后,加入足量的NaOH溶液
C. 加热溶液,通入足量的CO2
D. 与稀H2SO4共热后,加入足量的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备纳米Fe3O4,的流程示意图如下:

下列叙述错误的是
A. 为提高步骤①的反应速率,可采取搅拌、升温等措施
B. 步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+
C. 步骤④中,反应完成后剩余的H2O2无需除去
D. 步骤⑤中,“分离”包含的操作有过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物与人们的健康和生产生活密切相关。请回答下列问题:
(1)基态磷原子价电子轨道表示式为___________,其第一电离能比硫的___________(填“大”或“小”)。
(2).羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为___________,PO43-的空间构型为___________,该化合物所含元素电负性最大的是___________。
(3)P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键数目是___________。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___________,其为___________元酸,原因是___________。
(5)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如下图所示:

由图推知该多磷酸钙盐的通式为___________。
(6)磷化硼是一种超硬耐磨涂层材料,晶胞如下图所示,其密度为ρg/cm3,设NA是阿伏加德罗常数的值,则磷原子的配位数为___________,晶胞参数为___________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如下图:
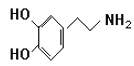
(1)多巴胺分子式:______________________。
(2)试判断多巴胺能发生的化学反应___________。
A.加成 B.取代 C.氧化 D.水解
(3)写出与多巴胺互为同分异构体且属于1、3、5三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1的所有物质的结构简式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_____________反应(填“吸热”或“放热”)。
(2)下列表述能作为反应达到化学平衡状态的标志是(________)
A.反应速率v(A)∶v(B)∶v(C)∶v(D) =1∶1∶1∶1
B.各组分的质量分数不再改变
C.混合气体的平均相对分子质量不再改变
II.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)从开始至2min,Z的平均反应速率为________________;
(2)向其中充入1 mol He(g)(He不参加反应),化学反应速率____________(填“加快”“减慢”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用所学知识回答下列问题:
(1)已知常温下,Ksp[Mg(OH)2]=5× ![]() ,若某溶液常温下刚 析出Mg(OH)2固体时,c(Mg2+)=5×
,若某溶液常温下刚 析出Mg(OH)2固体时,c(Mg2+)=5× ![]() mol/L,则此时溶液的pH=______。
mol/L,则此时溶液的pH=______。
(2)已知CH3COONH4溶液呈中性,又知CH3COOH溶液加到NaHCO3溶液中有气体放出,试推断常温下NH4HCO3溶液的pH______7(填“>”、“<”或“=”)。
(3)25℃时,pH=11的KOH溶液中,由水电离出的c(OH-)=_______mol/L。
(4)25℃时,pH=11的K2CO3溶液中,由水电离出的c(OH-)=_______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com