
����Ŀ�������£��� 20.0 g ��������Ϊ 14.0%�� KNO3��Һ�� 30.0 g ��������Ϊ 24.0%�� KNO3��Һ��ϣ��õ����ܶ�Ϊ1.15 g/cm3�Ļ����Һ�����㣺
��1����Ϻ���Һ����������_________��
��2����Ϻ���Һ�����ʵ���Ũ��_______��
��3����1000gˮ�����ܽ�______molKNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȣ�
��4�������44.8LHCl����ˮ���500mL��Һ�����㣺
��HCl�����ʵ���____________________��
��������Һ�����ʵ����ʵ���Ũ��____________________��
���𰸡�20%2.28mol/L2.482mol4mol/L
��������
��1����Ϻ���Һ�е�����Ϊ��20.0g+30.0g=50.0g����������ص�����Ϊ��20.0g��14%+30.0g��24%=10.0g����Ϻ���Һ������������![]() ��100%=20%���𣺻�Ϻ���Һ����������Ϊ20%��
��100%=20%���𣺻�Ϻ���Һ����������Ϊ20%��
��2�������Һ�����Ϊ��![]() =43.48mL=0.04348L����Һ�����ʵ����ʵ���Ϊ��
=43.48mL=0.04348L����Һ�����ʵ����ʵ���Ϊ��![]() =0.099mol����Ϻ���Һ�����ʵ���Ũ��Ϊ��
=0.099mol����Ϻ���Һ�����ʵ���Ũ��Ϊ��![]() =2.28mol/L���𣺻�Ϻ���Һ�����ʵ���Ũ��Ϊ2.28mol/L��
=2.28mol/L���𣺻�Ϻ���Һ�����ʵ���Ũ��Ϊ2.28mol/L��
��3������Ҫ����ص����ʵ���Ϊxmol������ص�����Ϊ101x�����ݣ�1����֪������ص���������Ϊ20%������=20%=![]() =
=![]() ��100%����ã�x��2.48mol������1 000gˮ�����ܽ�2.48molKNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ�������
��100%����ã�x��2.48mol������1 000gˮ�����ܽ�2.48molKNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ�������
��4���������44.8LHCl��n��HCl��=![]() =2mol����HCl�����ʵ���Ϊ2mol��
=2mol����HCl�����ʵ���Ϊ2mol��
�����500mL��Һ������Һ�����ʵ����ʵ���Ũ��c��HCl��=![]() =4mol/L������������Һ��HCl�����ʵ���Ũ��4mol/L��
=4mol/L������������Һ��HCl�����ʵ���Ũ��4mol/L��


 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5L 1mol/L FeCl3��Һ��0.2L 1mol/L KCl��Һ�е�Cl�������ʵ���Ũ��֮�ȣ� ��
A.5��2
B.3��1
C.15��2
D.1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ���칹���������ȷ����
A. ��Է���������ͬ���ṹ��ͬ�Ļ����ﻥ��Ϊͬ���칹��
B. ��ѧʽ��ͬ���ṹ��ͬ�Ļ����ﻥ��Ϊͬ���칹��
C. ͬ���칹��֮�����ڷ��������ͬ���������ǵ�������ͬ
D. ֻ���������л���֮�����ͬ���칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.���ӻ������в����ܺ����ۼ�
B.���ý�������÷ǽ�������ʱ���γ����Ӽ�
C.�ɷǽ���Ԫ���γɵĻ�����һ���ǹ��ۻ�����
D.���ۻ����ﲻ���ܺ������Ӽ�������״̬���Ե���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС���ڰ�����ʦ����ʵ���ҵĻ�ѧ�Լ�ʱ������һʢ��ɫ����Һ���Լ�ƿ����ǩ��������ͼ����С����������յ�֪ʶ����ҩƷ�������룬�����ʵ����֤��

��1����ʵ��ҩƷΪ��ѧ��ѧ�����Լ����Ʋ����������ӻ��ϼ�Ϊ______________________��
��2��ͬѧ���������������Ʋ⡣
����1��Na2SO4
ʵ������� ����������.֤����Na2SO4��Һ��
����2�� K2SO4
ʵ�������____________________________��֤����K2SO4��Һ��
����3�� (NH4)2SO4
ʵ�������____________________________��֤����(NH4)2SO4��Һ��
��3��ͨ��ʵ�鷢�֡�����3����������֪(NH4)2SO4�����ֽ⣬��С��������ͼ��ʾװ��̽����ֽ������гֺͼ���װ������
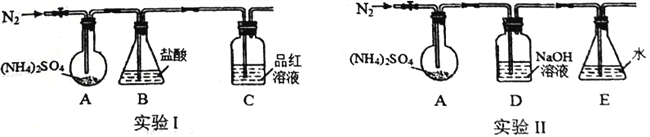
ʵ��I��װ��B ʢ0.5000mol/L����50.00mL��ͨ��N2�ž�������װ��A ������260��һ��ʱ�䣬ֹͣ���ȣ�ֹͣͨ��N2��Ʒ����Һ����ɫ��ȡ��װ��B����0.1000mol/LNaOH��Һ�ζ�ʣ�����ᣬ����NaOH ��Һ50.00mL��������ζ������Һ����SO42-��
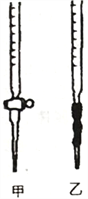
�������ͼѡ��ʢ��0.1000mol/LNaOH ��Һ�ĵζ���____________����ס�������������
��װ��B ����Һ������������ʵ�����_____________________mol��
ʵ������ͨ��N2�ž�������װ��A ���ȵ�400����������������ֹͣ���ȣ�ֹͣͨ��N2���۲쵽װ��A��D֮��ĵ���������������ɫ���塣�����飬�ð�ɫ�����װ��D����Һ����SO32-����SO42-��
��װ��E ��������____________________________��
��A��D֮��ĵ������ڵ�������ɫ������____________________________��
����ͬѧ�����AD֮����Ҫ����һ���������İ�ȫƿ����ʦ˵����Ҫ��ԭ����____________________________��
����һ���о����֣�������������������(NH4)2SO4��400���ֽ�Ļ�ѧ����ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪK=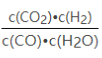 ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�����±���
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�����±���

�����й���������ȷ���ǣ� ��
A. �÷�Ӧ�Ļ�ѧ����ʽ��CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
B. ������Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. ����һ��������ܱ�������ͨ��CO2��H2��1mol��5 min���¶����ߵ�830�棬��ʱ���CO2Ϊ0.4 molʱ���÷�Ӧ�ﵽƽ��״̬
D. ��ƽ��Ũ�ȷ������й�ϵʽ�� ![]() �����ʱ���¶�Ϊ1000��
�����ʱ���¶�Ϊ1000��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮCaCl2����ǿ�ҵ���ʪ�ԣ��ڿ������׳��⣬���������������ˮ���������������ȡ��Թ�ҵ̼��ƿ�ʯ����������SiO2 ��Fe2O3��Al2O3��FeCO3�����ʣ�������ˮ�Ȼ��Ƶ���Ҫ�������£�
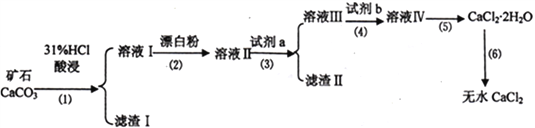
��1��Ϊ����߲��裨1���ķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��________________________��
��2�������Լ�b ��Ŀ����ʹ��Һ�ữ���Լ�b ����ѡ�������Լ�__________������ţ���
������ ������ �������� ������
��3��д�����裨2�������ӷ���ʽ______________________________��
��4�����裨5���õ��IJ�������������Ũ����______________________________��
��5����֪A13+��Fe2+��Fe3+�����������������pH ���£�
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
��ʼ���� | 3.7 | ��ʼ�ܽ� | 7.8 | 6.5 | 1.5 |
������ȫ | 5.3 | ��ȫ�ܽ� | 10.0 | 9.7 | 3.3 |
�����Լ�a��Ŀ���ǵ�����Һ��pH������pH �ķ�ΧΪ_______________________________��
��6����֪ijһ�¶�ʱKsp[Fe(OH)3]=8.0��10-38����0.01 mol��L-1��FeCl3 ��Һ�м���NaOH ���壬������Һ��������䣬Ҫ����Fe(OH)3������Ӧʹ��Һ�е�c(OH-)��СΪ__________mol��L-1��Fe3+������ȫʱ����Һ��c(OH-) ��СΪ__________mol��L-1��
��7���ⶨ��Ʒ��Cl-�����ķ����ǣ�a.��ȡ0.7500g ��Ʒ���ܽ⣬��250mL ����ƿ�ж��ݣ�b.��ȡ25.00mL ����Һ����ƿ�У� c.��0.05000mol��L-1AgNO3 ��Һ�ζ����յ㣬����AgNO3��Һ�����ƽ��ֵΪ25.00mL������������Ʒ��CaCl2 ����������Ϊ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ľṹ����ͼ��ʾ�����ڿ������������ȷ����

A. �뿧����Ĺ�������ȫ��ͬ�����������������ұ�����ֻ��3��ȡ������ͬ���칹����������˳���칹����11��
B. ������ķ���ʽΪC9H6O4
C. ��������![]() ��Ϊͬϵ��
��Ϊͬϵ��
D. 1mol ������������NaHCO3��Һ��Ӧ����3mol ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鼰�仯�������Ź㷺����;���������ֳ��������ᣬ����(H3AsO4)��������(H3AsO3)����֪����(H3AsO4)��pKa1��pKa2��pKa3����Ϊ2.25��6.77��11.40(pKa=-lgKa)���ش���������:
��1����֪:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)��Hl
H2(g)+2O2(g)=H3AsO4(s)��Hl
H2(g)+![]() O2(g)=H2O(1)��H2
O2(g)=H2O(1)��H2
As(s)+ ![]() O2(g)=
O2(g)= ![]() As2O5(s) ��H3
As2O5(s) ��H3
��ӦAs2O5(g)+3H2O(1)=2H3AsO4(s) ��H=_________��
��2��д������(H3AsO4)�ĵڶ������뷽��ʽ___________________________________��
��3��NaH2AsO4��Һ��______(������������������������������),��ͨ������˵��________________________��
��4��������(H3AsO3)ˮ��Һ�д��ڶ�������̬���������ֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)����Һ��pH��ϵ����ͼ��ʾ��

�Է�̪Ϊָʾ��(��ɫ��ΧpH8.2~10.0)����NaOH��Һ��μ��뵽H3AsO3��Һ�У�����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӡ��ù�������Ҫ��Ӧ�����ӷ���ʽΪ__________________________��
��5��ij��ѧ��ȤС��ͬѧ��̽�����淴ӦAsO33-+I2+2OH-![]() AsO43-+2I-+H2O���������ͼI��ʾװ�á�ʵ�����������:��ͼIװ�ü����Լ�������װ�ã�������C2����C1����������Ϊ��ʱ����ͼIװ������ձ�����μ���һ����2mol/L���ᣬ�����ֲ���������ʵ���е�����ʱ��Ĺ�ϵ��ͼII��ʾ��
AsO43-+2I-+H2O���������ͼI��ʾװ�á�ʵ�����������:��ͼIװ�ü����Լ�������װ�ã�������C2����C1����������Ϊ��ʱ����ͼIװ������ձ�����μ���һ����2mol/L���ᣬ�����ֲ���������ʵ���е�����ʱ��Ĺ�ϵ��ͼII��ʾ��

��ͼII��AsO43-���淴Ӧ����:a____b(����>������<������=��)��
��д��ͼII��c���ӦͼIװ�õ�������Ӧʽ__________________________��
�����жϸ÷�Ӧ�ﵽƽ��״̬����________________��
a.2v(I-)��=v(AsO33-)�� b.��Һ��pH���ٱ仯
c.������ʾ����Ϊ�� d.��Һ��ɫ���ٱ仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com