
分析 (1)能使湿润的红色石蕊试纸变蓝的气体是氨气,证明铵根离子的存在,白色溶于氢氧化钠的沉淀是氢氧化铝,和Ba(OH)2溶液反应生成的白色不溶于硝酸的白色沉淀是硫酸钡;
(2)根据电荷守恒和原子守恒来确定该结晶水合物的化学式;
(3)n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,根据反应方程式中氢氧化钡和硫酸钡、氢氧化铝之间的关系式计算沉淀质量.
解答 解:(1)一份加入足量Ba(OH)2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,证明一定含有铵根离子;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有铝离子,
答:该结晶水合物中含有的两种阳离子为NH4+、Al3+;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42-)=$\frac{46.6g}{233g/mol}$=0.2mol,n(NH4+)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42-)可得:n(Al3+)=$\frac{1}{3}$(2×0.2mol-0.1 mol)=0.1 mol,
则含有结晶水的物质的量为:n(H2O)=$\frac{45.3g-0.1mol×(27+18)g/mol-0.2mol×96g/mol}{18g/mol}$=1.2mol,
所以1.96g的该结晶水合物中:m(NH4+):n(Al3+):n(SO42-):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,
故该结晶水合物的化学式为:NH4Al(SO4)2•12H2O[或(NH4)2SO4•Al2(SO4)3•24H2O],
答:该结晶水合物的化学式为NH4Al(SO4)2•12H2O[或(NH4)2SO4•Al2(SO4)3•24H2O];
(3)45.3g晶体的物质的量为:$\frac{45.3g}{453g/mol}$,n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,n(NH4Al(SO4)2):n(Ba(OH)2)=0.1mol:0.15mol=$\frac{2}{3}$>$\frac{1}{2}$,所以氢氧化钡不足量,根据原子守恒知,生成硫酸钡沉淀的物质的量为:n(BaSO4)=n(Ba(OH)2)=0.15mol,生成n(Al(OH)3)=$\frac{2}{3}$n(Ba(OH)2)=0.1mol,
所以沉淀的质量为:0.15mol×233g/mol+0.1mol×78g/mol=34.95g+7.8g=42.75g,
答:若只加入75mL的Ba(OH)2溶液,得到的沉淀质量为42.75.
点评 本题考查了复杂化学式确定的计算,题目难度中等,注意从守恒的角度推断结晶水合物的化学式,注意(3)中要进行过量计算,为易错点,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-l CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
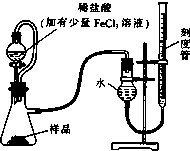 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化三碳的电子式为  | B. | C3O2、CO、CO2都是碳的氧化物 | ||
| C. | C3O2和CO2中原子不全为sp杂化 | D. | C3O2不是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
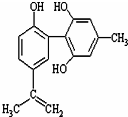 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 该物质的分子式为C16H15O3 | |
| B. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol 和7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子的每一个能层最多可容纳的电子数为2n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 1个原子轨道里最多只能容纳2个电子,但自旋方向相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯用带橡胶塞的试剂瓶贮存 | B. | 浓硝酸存放在棕色试剂瓶中 | ||
| C. | 少量白磷存放在水中 | D. | 少量金属钠存放在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使元素的化合态转化成游离态的过程就是还原的过程 | |
| B. | 金属冶炼的实质是金属元素被氧化 | |
| C. | 电解熔融氧化铝时,每还原出1 kg铝,必有111mol电子转移 | |
| D. | 工业上常用电解NaCl水溶液的方法制取金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
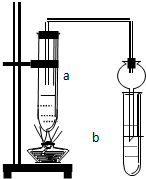 如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com