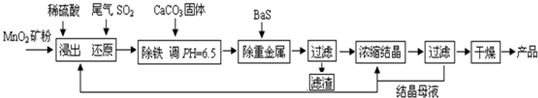
�⣺��1����ӦF��Al����N��NaOH����Һ��Ӧ�����ӷ���ʽΪ��2Al+2OH
-+2H
20=2AlO
2-+3H
2����
�ʴ�Ϊ��2Al+2OH
-+2H
20=2AlO
2-+3H
2����
��2����Ӧ��ΪH
2O
2+SO
2=H
2SO
4��1mol������H
2O
2������Ӧ������ת��2mol���е���1mol����ת��ʱ������H
2O
2���ʵ���0.5mol������=0.5mol��34g/mol=17g���ʴ�Ϊ��17g��
��3����Ӧ���ǵ��ʳ��ˮ�ķ�Ӧ����Ӧ�����ӷ���ʽΪ��2Cl
-+2H
2O

Cl
2��+H
2��+2OH
-����װ����ʹ�õ��������ӽ���Ĥ������d���ռ�������NaOH��Һ��
�ʴ�Ϊ��2Cl
-+2H
2O

Cl
2��+H
2��+2OH
- NaOH��Һ��
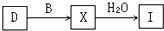
��4����D��SO
2����B��O
2����Ӧ����X��SO
3���ķ�Ӧ���Ƕ�����������Ĵ��������ڽӴ����н��У���ӦΪ2SO
2��g��+
O
2��g��?2SO
3��g������H=-196.6KJ/mol�����SO
2��ת���ʣ���Ҫƽ��������У���ʵ���������ۺϿ��Ǹ������ط�����
�ٷ�Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У���������ת���ʼ�С���ʢٴ���
������ѹǿƽ�������������С�ķ�����У���������ת�����������´��������¶�������ת�����Ѿ��ܸߣ�����ѹǿ��߲��ʢڴ���
�۴���ֻ�ı����ʣ����ı�ƽ�⣬�ʢ۴���
�ܼ�ʱ���������ƽ��������У���������ת����������ȷ��
���ʵ�����������Ũ�Ȼ���߶��������ת���ʣ��ʢ���ȷ��
����Ӧ�������������Ƚ������н����Ƚ������Ƿ�Ӧ�������¶Ƚ��ͣ��ٽ�ƽ��������У��ʢ���ȷ��
��ѡ�ܢݢޣ�
�ʴ�Ϊ���ۣ��ܢݢޣ�
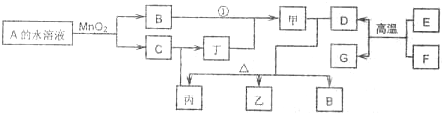
����������ת����ϵ�͵��ԭ�����ƶϣ�MΪNaCl�����ɵ���ҺNΪNaOH������ΪH
2��Cl
2��F��N��NaOH����Ӧ���ɵ���H
2�����ԣ�FΪAl��RΪO
2��GΪAl
2O
3��JΪH
2��PΪCl
2��F��Al��+C=G��Al
2O
3��+H��Fe�����ƶ�HΪFe��CΪFe
2O
3�����ݣ�4���ṩ��Ϣ��֪IΪH
2SO
4��DΪSO
2��XΪSO
3������H��Fe��+I��H
2SO
4��=J��H
2��+K��FeSO
4�����ƶ�KΪFeSO
4��EΪ������ԭ�Ӹ�����Ϊ1��l��Һ�壬�����ƶ�ΪH
2O
2�����A+B
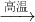
C��Fe
2O
3��+D��SO
2����A����Է�������Ϊ120���ж�AΪFeS
2��BΪO
2�������жϳ������ʷ����ش����⣻
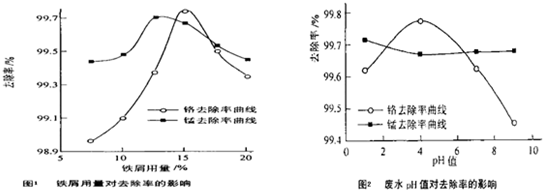
���������⿼��������ת����ϵ���������ʵ��ۺ�Ӧ�ã���Ҫ���鹤ҵ������Ӧ�õij�����Ӧ����ҵ�����ᡢ���ʳ��ˮ���ռ���ȷ�Ӧ�����ұ������ԭ����Ӧ�ã����ӷ���ʽ����ѧ����ʽ����д����ѧƽ���Ӱ�������жϣ�������ԭ��Ӧ��Ӧ�õȣ��ۺ��Խ�ǿ��

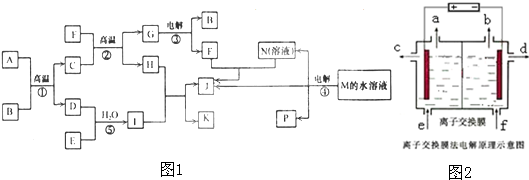
 Cl2��+H2��+2OH-����װ����ʹ�õ��������ӽ���Ĥ������d���ռ�������NaOH��Һ��
Cl2��+H2��+2OH-����װ����ʹ�õ��������ӽ���Ĥ������d���ռ�������NaOH��Һ�� Cl2��+H2��+2OH- NaOH��Һ��
Cl2��+H2��+2OH- NaOH��Һ�� C��Fe2O3��+D��SO2����A����Է�������Ϊ120���ж�AΪFeS2��BΪO2�������жϳ������ʷ����ش����⣻
C��Fe2O3��+D��SO2����A����Է�������Ϊ120���ж�AΪFeS2��BΪO2�������жϳ������ʷ����ش����⣻

 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�