
某溶液 X 含有 H+、AL+、NH+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下现定)如下:
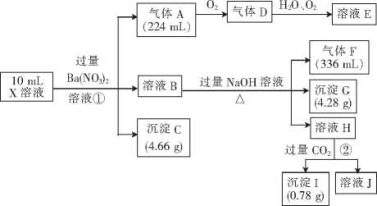
(1)通过上述实验过程,一定不存在的离子是 。
(2)反应①中生成A的离子方程式为 。
(3)若测得X溶液中c(H+ )=5mol • L-1,则X溶液中(填“含”或“不含”)Fe3+ ,c(Fe3+)=mol •L—1 (若填不含,则不需计算),X溶液中c(C1- )= mol•L
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关物质的分类或归类正确的是
①混合物:波尔多液、盐酸、水银
②化合物:氯化钾、甲烷、HD
③电解质:明矾、胆矾、硫酸钡
④非电解质:酒精、CO2、Cl2
⑤同位素:12C、13C、14C
A.③④ B.③⑤ C.②③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2016届安徽马鞍山、淮北、铜陵四校高三上第三次联考化学试卷(解析版) 题型:实验题
【化学—选修2:化学与技术】
金属钒素有“合金维生素”之称,普通钢中加入少量的钒(V)能极大地改善钢的弹性和强度。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中的钒的主要流程如下:
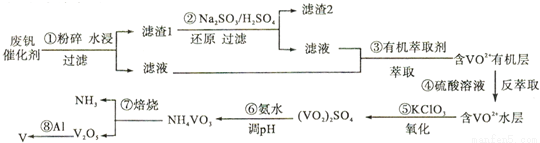
回答下列问题:
(1)滤渣l的主要成分是________________;
(2)步骤②中发生反应的离子方程式为________________;
(3)步骤③的变化过程可简化为(HA表示有机萃取剂)
VOSO4+(水层)+2HA2(有机层) VOA2(有机层)+H2SO4(水层),则步骤④中可选择硫酸作萃取剂的原因是________________;萃取和反萃取在实验室里用到的玻璃仪器有______和_____;
VOA2(有机层)+H2SO4(水层),则步骤④中可选择硫酸作萃取剂的原因是________________;萃取和反萃取在实验室里用到的玻璃仪器有______和_____;
(4)该工艺流程中,可以循环利用的物质除了氨气以外,还有____________;
(5)调节溶液pH,可将(VO2)SO4转变成NH4VO3沉淀;25℃时,当PH为1.7~1.8时,钒沉淀率为98.8%;假设其它各步反应都完全进行,已知KC1O3的还原产物是KCl,若每消耗1moiKC1O3,理论上可回收金属钒___________g(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料,其制取原理为:
Al2O3+3C+N2 2AlN+3CO。在制取氮化铝时由于反应不完全,产品中有氧化铝和碳。
2AlN+3CO。在制取氮化铝时由于反应不完全,产品中有氧化铝和碳。
为了分析某AlN样品的组成,某实验小组进行了如下探究。
【实验1】测定样品中氮元素的质量分数。
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
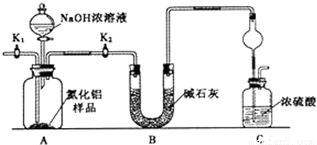
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(1)如图C装置中球形干燥管的作用是__________________________。
(2)完成以下实验步骤:组装好实验装置,首先___________,再加入实验药品.然后______,
打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,缓缓通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是__________。
(3)若去掉装置B,则导致测定结果____________(填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见_______________________。
【实验2】按以下步骤测定样品中铝元素的质量分数。
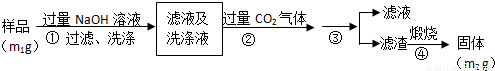
(4)步骤②生成沉淀的离子方程式为___________________。
(5)操作③需要的玻璃仪器有__________________________。
(6)A1元素的质量分数为________(用m1、m2表示)。
【实验3】测定样品中碳元素的质量分数。
称取10.00g样品置于反应器中,通往2.24LO2,在高温下充分反应后得到3.36L气体(AlN不跟O2反应),测得其密度为1.61g•L-1(体积及密度均已换算成标准状况)。
(7)计算该样品中碳元素的质量分数_____________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法正确的是( )
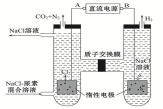
A.B为电源的正极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:填空题
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,试判断:
固体混合物中肯定有 ,肯定没有 ,可能有 ,对可能有的物质,可采用滤液中滴加 溶液方法来检验。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
如上右图装置可用于收集气体并验证其某些化学性质,下列相关的选项正确的是
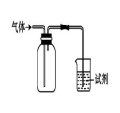
选项 | 气体 | 试剂 | 现象 | 结论 |
A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
B | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
C | HCl | 硅酸钠溶液 | 生成白色沉淀 | Cl的非金属性比Si强 |
D | X | KI淀粉溶液 | 溶液变蓝 | X可能是Cl2 |
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三上12月月考理综化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ/mol
B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com