
【题目】以重要的化工原料A(C2H2)合成有机物E和 的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。

回答下列问题:
(1)B的系统命名是______________;已知C是顺式产物 ,则C的结构简式为_____________________________。
(2)写出⑤的化学方程式:________________________________,反应类型是________________。、
(3)反应⑧产物与新制Cu(OH)2的化学方程式:______________________________。
(4)符合下列条件肉桂酸( )的同分异构体有多种,①分子中含有苯环和碳碳双键,②能够发生银镜反应,③遇FeCl3溶液显紫色,写出其中核磁共振氢谱图中有六组峰,且峰面积之比为1∶1∶1∶1∶2∶2的结构简式_________________。
)的同分异构体有多种,①分子中含有苯环和碳碳双键,②能够发生银镜反应,③遇FeCl3溶液显紫色,写出其中核磁共振氢谱图中有六组峰,且峰面积之比为1∶1∶1∶1∶2∶2的结构简式_________________。
【答案】 2-丁炔 ![]()
![]() + CH3CH2CHOHCH3
+ CH3CH2CHOHCH3![]()
![]() +H2O 取代反应(酯化反应) OHC-CH=CH-CHO+4Cu(OH)2+2NaOH
+H2O 取代反应(酯化反应) OHC-CH=CH-CHO+4Cu(OH)2+2NaOH![]() NaOOC-CH=CH-COONa+2Cu2O↓+6H2O 略
NaOOC-CH=CH-COONa+2Cu2O↓+6H2O 略
【解析】乙炔与NaNH2发生取代反应生成NaC≡CNa,结合B的分子式可知反应②为取代反应,则B为CH3C≡CCH3,对比B、C分子式可知反应③为加成反应,则C为CH3CH=CHCH3,D在一定条件下可被氧化成酮,则D为CH3CH2CHOHCH3,反应⑤为酯化反应,则E为![]() 。1分子乙炔与2分子HCHO发生加成反应生成HOCH2C≡CCH2OH,与氢气发生加成反应生成F,F发生氧化反应得到OHC-CH=CH-CHO,则F为HOCH2CH=CHCH2OH,OHC-CH=CH-CHO与氨气转化得到吡咯。则
。1分子乙炔与2分子HCHO发生加成反应生成HOCH2C≡CCH2OH,与氢气发生加成反应生成F,F发生氧化反应得到OHC-CH=CH-CHO,则F为HOCH2CH=CHCH2OH,OHC-CH=CH-CHO与氨气转化得到吡咯。则
(1)B为CH3C≡CCH3,系统命名是2-丁炔;已知C是顺式产物 ,则C的结构简式为![]() 。(2)反应⑤是酯化反应,反应的化学方程式为
。(2)反应⑤是酯化反应,反应的化学方程式为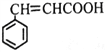 + CH3CH2CHOHCH3
+ CH3CH2CHOHCH3![]()
![]() +H2O。(3)反应⑧产物含有醛基,与新制Cu(OH)2的化学方程式为OHC-CH=CH-CHO+4Cu(OH)2+2NaOH
+H2O。(3)反应⑧产物含有醛基,与新制Cu(OH)2的化学方程式为OHC-CH=CH-CHO+4Cu(OH)2+2NaOH![]() NaOOC-CH=CH-COONa+2Cu2O↓+6H2O。(4)①分子中含有苯环和碳碳双键,②能够发生银镜反应,含有醛基,③遇FeCl3溶液显紫色,还含有酚羟基,则其中核磁共振氢谱图中有六组峰,且峰面积之比为1∶1∶1∶1∶2∶2的结构简式为
NaOOC-CH=CH-COONa+2Cu2O↓+6H2O。(4)①分子中含有苯环和碳碳双键,②能够发生银镜反应,含有醛基,③遇FeCl3溶液显紫色,还含有酚羟基,则其中核磁共振氢谱图中有六组峰,且峰面积之比为1∶1∶1∶1∶2∶2的结构简式为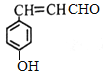 。
。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是
A. 点燃爆竹后,硫燃烧生成SO3
B. 中国古代利用明矾溶液的酸性清除铜镜表明的铜锈
C. 服用阿司匹林出现水杨酸反应时,用NaOH溶液解毒
D. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,器合成路线如下:
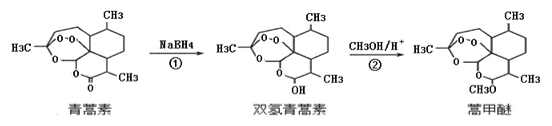
下列说法不正确的是()
A. 青蒿素的分子式是C15H22O5,属于烃的衍生物
B. 双氢青蒿素中含有过氧键,遇湿润的淀粉碘化钾试纸立刻显蓝色
C. 蒿甲醚可以犮生水解反应
D. 反应②为取代反应,有H2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,都是由极性键构成极性分子的一组是( )
A. NO2和CH4 B. NH3和H2O C. H2S和CCl4 D. HCl和C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子中每个原子接2个单键和1个双键,它与F2发生加成反应,其加成产物为_____;C60的晶体中,每个C60晶胞的质量为_______。(用含NA的式子表示)
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_______。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶休的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为_______,B原子与N原子之间共价键与配价键的数目比为_____,一个晶胞中N 原子数目为_______。

(5)炭与孔雀石共热可以得到金属铜,基态铜原子的电子排布式为_______,铜采用_____堆积,则铜的晶体中Cu 原子的配位数为________。已知铜单质的晶体密度为pg/cm3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的半径为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
D | 液溴 | 苯 | 生成白雾 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、离子键、范德华力、氢键和金属键是构成物质粒子间的不同作用方式。下列物质中,只含有上述一种作用的是( )
A. 冰 B. 氢氧化钠 C. 铁 D. 石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。
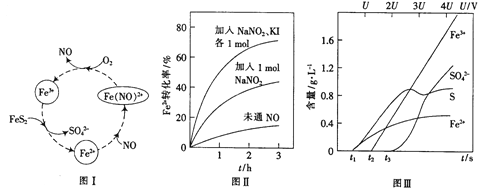
(1)写出如图中Fe3+与FeS2反应的离子方程式:______________。
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________。
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
①写出t1至t2间FeS2所发生的电极反应式:__________。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com