
下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
②无色溶液中:K+、Na+、MnO4﹣、SO42﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
④含有Fe2+的溶液中:[Fe(CN)6]3﹣、NO3﹣、Cl﹣
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、Br﹣.
|
| A. | ①⑤ | B. | ②③ | C. | ②④ | D. | ③⑤ |
考点:
离子共存问题.
专题:
离子反应专题.
分析:
①pH=11的溶液,显碱性;
②MnO4﹣在水溶液中显紫红色;
③加入Al能放出H2的溶液,为酸或强碱溶液;
④Fe2+、[Fe(CN)6]3﹣结合生成沉淀;
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液,为酸或碱溶液.
解答:
解:①pH=11的溶液,显碱性,该组离子之间不反应,则能够共存,故①正确;
②MnO4﹣在水溶液中显紫红色,与无色溶液不符,故②错误;
③加入Al能放出H2的溶液,为酸或强碱溶液,HCO3﹣既能与酸反应又能与碱反应,则不能共存,故③错误;
④Fe2+、[Fe(CN)6]3﹣结合生成沉淀,则不能共存,故④错误;
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液,为酸或碱溶液,无论酸或碱溶液中该组离子之间不反应,则能共存,故⑤正确;
故选A.
点评:
本题考查离子的共存,熟悉信息及离子之间的反应(发生氧化还原反应的离子)是解答本题的关键,④为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:
.下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
|
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于能量判据和熵判据的说法中,不正确的是( )
|
| A. | 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
|
| B. | 由能量判据和熵判据组合成的复合判据,将更适合于所有的过程 |
|
| C. | 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行 |
|
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
②用标准溶液润洗滴定管2﹣3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2﹣3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
(2)上述②操作的目的是
(3)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶 .
(5)滴定结束后如仰视观察滴定管中液面刻度
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10﹣10 | 1.4×10﹣5 | 6.3×10﹣50 | 7.7×10﹣13 | 8.51×10﹣16 |
|
| A. | 五种物质在常温下溶解度最大的是Ag2SO4 |
|
| B. | 将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀 |
|
| C. | 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |
|
| D. | 常温下,AgCl、AgBr和AgI三种物质的溶解度随着氯、溴、碘的顺序逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是( )
①滴有石蕊试液的碳酸
②滴有石蕊试液的NH4Cl溶液
③滴有石蕊试液的硫酸
④滴有酚酞试液的氨水
⑤滴有酚酞试液的氢氧化钠溶液
⑥滴有酚酞试液的饱和氢氧化钙溶液
⑦滴有酚酞试液的Na2CO3溶液
⑧溶有SO2的品红溶液.
|
| A. | ①④⑥ | B. | ④⑥ | C. | ③⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如果类似于水的离子积Kw,溶液中c(Ag+)和c(Cl﹣)的乘积是一个常数:c(Ag+)•c(Cl﹣)=1.0×10﹣10,当溶液中c(Ag+)•c(Cl﹣)大于1.0×10﹣10时,才可能产生AgCl沉淀.现向50mL 0.018mol•L﹣1的AgNO3溶液中加入50mL 0.02mol•L﹣1的盐酸,生成了沉淀.求:
(1)沉淀生成后溶液中c(Ag+)是多少?
(2)沉淀生成后溶液的pH是多少?
(3)如果向沉淀生成后的溶液中再加入50mL 0.001mol•L﹣1的盐酸,将会观察到什么现象?
查看答案和解析>>
科目:高中化学 来源: 题型:
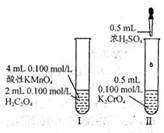
研究教材中演示实验,如右图所示,下列有关分析正确是
A.I、II中随反应进行反应速率均逐渐减小,直至为零
B.H2C2O4和H2SO4均为电解质
C.反应I和II均为氧化还原反应
D.其他条件不变,若将I反应中H2C2O4浓度改为0.2 mol·L-1,溶液褪色时间缩短,是因为增大反应物浓度,反应物中活化分子百分数提高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com