

分析 Ⅰ.以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其中铁和铜于通入的气体X为氯气反应生成氯化铁和氯化铜加入浓盐酸酸溶后加入氢氧化钠溶液调节溶液PH除去氯化铁,过滤得到滤液中通入二氧化硫反应生成CuCl沉淀,氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐,用蒸馏水、乙醇洗涤在真空中干燥得到纯净的氯化亚铜,
(1)上述分析可知X为氯气,酸溶抑制Fe3+、Cu2+的水解,且不引入杂质;
(2)结合溶度积常数计算铁离子全部沉淀完全的PH和铜离子开始沉淀的PH分析PH范围;
(3)反应2是氯化铜溶液中通入二氧化硫发生氧化还原反应,生成氯化亚铜沉淀;
(4)实验提纯析出的CuCl粗晶体,可以先蒸馏水洗涤,后用乙醇洗涤后干燥;
Ⅱ.(5)铜与电源正极连接,通电后铜失去电子在碱性溶液中生成氧化亚铜;
(6)酸性介质中Cu2O不能稳定存在,潮湿的空气中可缓慢被氧化成CuO,氮气性质稳定可以起到保护气的作用.
解答 解:Ⅰ.以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其中铁和铜于通入的气体X为氯气反应生成氯化铁和氯化铜加入浓盐酸酸溶后加入氢氧化钠溶液调节溶液PH除去氯化铁,过滤得到滤液中通入二氧化硫反应生成CuCl沉淀,氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐,用蒸馏水、乙醇洗涤在真空中干燥得到纯净的氯化亚铜,
(1)上述分析可知气体X为氯气,铁和铜于通入的气体X为氯气反应生成氯化铁和氯化铜,“酸溶”采用浓盐酸的原因是抑制Fe3+、Cu2+的水解,且不引入杂质,
故答案为:Cl2;抑制Fe3+、Cu2+的水解,且不引入杂质;
(2)c(CuCl2)=5mol•L-1,c(FeCl3)=1mol•L-1.已知:Kap(Fe(OH)3)=4.0×10-38,Kap(Cu(OH)2)=4.8×10-20,当溶液中金属离子的浓度小于时可认为其沉淀完全,铁离子完全沉淀溶液的氢氧根离子浓度c3(OH-)=$\frac{Ksp}{c(F{e}^{3+})}$=$\frac{4.0×1{0}^{-38}}{1{0}^{-5}}$=4.0×10-33,c(OH-)=$\root{3}{4.0×1{0}^{-33}}$=1.6×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1.6×1{0}^{-11}}$=6.25×10-4mol/L,PH=-lg6.25×10-4=4-0.8=3.2≈3,铜离子开始沉淀的溶液PH,Kap(Cu(OH)2)=4.8×10-20=c(Cu2+)c2(OH-)=5mol/L×c2(OH-)=,c(OH-)=$\sqrt{\frac{4.8×1{0}^{-20}}{5}}$=$\sqrt{0.96×1{0}^{-20}}$=2×10-10mol/L,c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-10}}$=5×10-5mol/L,PH=5-0.7=4.3,上述流程中滴加NaOH溶液调节pH,其范围约为3~4,
故答案为:3~4;
(3)反应2是氯化铜溶液中通入二氧化硫发生氧化还原反应,生成氯化亚铜沉淀,反应的离子方程式为:2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+,
故答案为:2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(4)氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,提纯析出的CuCl粗晶体,可以先蒸馏水洗涤,后用乙醇洗涤后干燥,将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干,
故答案为:将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干;
Ⅱ.(5)装置中分析可知,铜与电源正极连接为电解池的阳极,通电后阳极上铜失去电子在碱性溶液中生成氧化亚铜,电极反应为:2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(6)电解过程中从烧杯底部通入N2,其可能的作用:搅动溶液,使OH-迅速扩散,作为保护气防止空气中的氧气氧化电解产生的Cu2O,
故答案为:作为保护气防止空气中的氧气氧化电解产生的Cu2O.
点评 本题考查了物质分离提纯、物质性质、溶度积常数的计算应用、电解池原理和电极反应书写等知识点,掌握基础是解题关键,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热是1 mol物质参加反应时的能量变化 | |
| B. | 当反应放热时△H>0,反应吸热时△H<0 | |
| C. | 任何条件下,化学反应的焓变都等于化学反应的反应热 | |
| D. | 在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:1,1-二甲基乙醇 | B. | 有机物CH3CH=CHCH2OH的键线式为: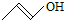 | ||
| C. | 乙醇分子的球棍模型: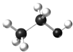 | D. | 氨基的电子式: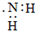 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢分子的电子式: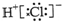 | B. | 乙烯的分子式:C2H6 | ||
| C. | 二氧化碳分子的结构式:O-C-O | D. | CH4分子的球棍模型: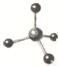 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com