
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ������������壨FeSO47H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʣ�ʵ�鲽����ͼ�� 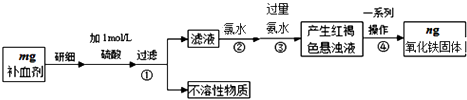
��1��ʵ�������Ѿ�ȷ��ȡ��Ũ��������500mL 1molL��1��������Һ��������ʱ�õ����������ձ����������⣬�������������� �� ��
��2������ڼ��������ˮ�������� �� ��Ӧ�����ӷ���ʽΪ ��
��3���������һϵ�в�������Ϊ��ϴ�ӡ����ա���ȴ��������
��4����ʵ������ģ���ò�Ѫ������Ԫ�ص���������Ϊ ��
��5�����в����ᵼ�����ⶨ����Ԫ�غ���ƫ�ߵ��� A����������Ӱ�ˮ������
B�������ϴ�Ӳ����
C����������ղ���֣�
��6��ijͬѧ���ֲ��ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1molL��1��������Һ�����ˣ�ȡ��Һ����Һ������Һ���ɫ��˵���ò�Ѫ���ѱ��ʣ�
���𰸡�
��1��500mL����ƿ����ͷ�ι�
��2����Fe2+ȫ������ΪFe3+��2Fe2++Cl2=2Fe3++2Cl��
��3������
��4��![]() %
%
��5��B��C
��6��KSN����
���������⣺������ͼ��֪����ʵ��ԭ��Ϊ����ҩƷ�е�Fe2+�γ���Һ����Fe2+����ΪFe3+ �� ʹFe3+ת��Ϊ����������������ת��Ϊ��������ͨ���ⶨ�����������������㲹Ѫ������Ԫ�صĺ�������1������Ͳ��ȡŨ������������ձ���ϡ�ͣ����ò��������裬��ȴ������500mL����ƿ�У�ϴ�ӡ���ˮ���ݣ�����̶���1��2cm���ý�ͷ�ιܣ�����ʱ�õ����������ձ����������⣬�������������ǣ�500mL����ƿ����ͷ�ιܣ����Դ��ǣ�500mL����ƿ����ͷ�ιܣ���2�������������ˮ��Fe2+��ȫ����ΪFe3+ �� ��Ӧ���ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl�� �� ���Դ��ǣ���Fe2+ȫ������ΪFe3+��2Fe2++Cl2=2Fe3++2Cl������3���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ����������������������Դ��ǣ�ϴ�ӣ���4�����������Ϊag��������������Ԫ�ص�����Ϊ ![]() ��n g=0.7n g���ʲ�Ѫ������Ԫ�ص���������Ϊ
��n g=0.7n g���ʲ�Ѫ������Ԫ�ص���������Ϊ ![]() ��100%=
��100%= ![]() %�����Դ��ǣ�
%�����Դ��ǣ� ![]() %����5��A����������Ӱ�ˮ�����㣬�����Ӳ�����ȫת��Ϊ���������������ⶨ������������ƫС������Ԫ����������ƫС����A�����ϣ�B�������ϴ�Ӳ���֣����������ḽ�����ʣ��ⶨ������������ƫ����Ԫ����������ƫ�ߣ���B���ϣ�C����������ղ���֣����������ֽⲻ��ȫ���ⶨ������������ƫ����Ԫ����������ƫ�ߣ���C���ϣ���ѡ��BC����6����Ѫ������ʱFe2+������ΪFe3+ �� ���˺�ȡ��Һ��KSCN��Һ������Һ��ɺ�ɫ��˵���ò�Ѫ���ѱ��ʣ����Դ��ǣ�KSCN���죮
%����5��A����������Ӱ�ˮ�����㣬�����Ӳ�����ȫת��Ϊ���������������ⶨ������������ƫС������Ԫ����������ƫС����A�����ϣ�B�������ϴ�Ӳ���֣����������ḽ�����ʣ��ⶨ������������ƫ����Ԫ����������ƫ�ߣ���B���ϣ�C����������ղ���֣����������ֽⲻ��ȫ���ⶨ������������ƫ����Ԫ����������ƫ�ߣ���C���ϣ���ѡ��BC����6����Ѫ������ʱFe2+������ΪFe3+ �� ���˺�ȡ��Һ��KSCN��Һ������Һ��ɺ�ɫ��˵���ò�Ѫ���ѱ��ʣ����Դ��ǣ�KSCN���죮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������N2H4������һ�ֹ�ҵԭ�ϣ�����һ����Ҫ�Ĺ�ҵ��Ʒ��
��1��ʵ���ҿ����Ȼ������ʯ�ҷ�Ӧ��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��2��������һ�������¿ɰ���ʽ�ֽ⣺3N2H4��g��=N2��g��+4NH3��g������֪����1molN��H��N��N��N��N�����յ���������Ϊ390.8kJ��193kJ��946kJ��������1molN2 �� ��Ӧ����ų��������ա���kJ��������
��3��NH3��O2ȼ�ϵ�صĽṹ��ͼ��ʾ�� 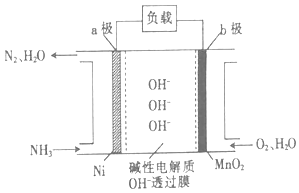
��a��Ϊ��ص������������������
�ڵ�����1molN2ʱ����·���������ӵ����ʵ���Ϊ ��
��4���������Ը�Ч���ѳ��̵����е�NO�Ӷ�����N2 �� �÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ����ͼ��ʾ�������л�ѧ��Ӧ��������3���ǣ������� 
A.2H2+O2 ![]() 2H2O
2H2O
B.2NaHCO3 ![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
C.CuO+CO ![]() Cu+CO2
Cu+CO2
D.Zn+H2SO4=ZnSO4+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��������٤��������ֵ������˵����ȷ���ǣ�������
A.7.1g����������������������Һ��Ӧת�Ƶĵ�����Ϊ0.2��6.02��1023
B.50ml 12mol/L����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA
C.0.1molNa2O2������������̼��ַ�Ӧת�Ƶĵ�����Ϊ0.2NA
D.0.1molFe��0.1mol������ȼ�գ�ת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӧ��������Ⱦ�����ƿ���������Ҫ�Ӷ�����֣�
��1���о����֣�NOx����������Ҫ�ɷ�֮һ��NOx��Ҫ��Դ������β����
��֪��N2��g��+O2��g��2NO��g����H=+180.50kJmol��1
2CO��g��+O2��g��2CO2��g����H=��566.00kJmol��1
Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2���������������Դ�ɼ�����Ⱦ������������⣮�״���һ�ֿ������������Դ�����й����Ŀ�����Ӧ��ǰ����һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��CH3OH��g������2L�ܱ������г������ʵ���֮��Ϊ1��2��CO��H2 �� �ڴ��������³�ַ�Ӧ��ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ1��ʾ�� 
��i���÷�Ӧ�ķ�Ӧ�ȡ�H0���������������ѹǿ����Դ�С��P1P2���������������
��ii���÷�Ӧ��ѧƽ�ⳣ������ʽΪ ��
��iii�����и����У�����˵���÷�Ӧ�Ѿ��ﵽƽ����� ��
A������������ѹǿ���ٱ仯
B��v��CO����v��H2����v��CH3OH��=1��2��1
C�������ڵ��ܶȲ��ٱ仯
D�������ڻ�������ƽ����Է����������ٱ仯
E�������ڸ���ֵ������������ٱ仯
��iv��ij�¶��£��ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��������ĸ����
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C�����ƶ�
�������жϵ������� ��
��3������ȼ�շ�Ӧԭ�����ϳɵļ״����������ͼ2��ʾ��ȼ�ϵ��װ�ã�
��i�������缫��ӦʽΪ ��
��ii����ع���ʱ��������ǿ��ΪI��1��������������Ϊq��NAΪ����٤��������ֵ�����װ��ÿ�������ļ״������ʵ���Ϊmol�����軯ѧ��ȫ��ת��Ϊ���ܣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�Ӻ�������Լ����ӵ��˶�������������ȷ���ǣ� �� �ٿ��Բⶨijһʱ�̵�����ԭ����������λ��
�ڵ���������С�Ҵ������
�۵�����ԭ�����С����������˶��ռ�
���˶��ٶȽӽ�����
����������һ���й̶����˶����
���ִ����Ƚ���ɨ����������Ҳ�۲첻�����ӵ��˶���
A.�٢ڢۢ�
B.�ڢۢܢ�
C.�ۢܢݢ�
D.�ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ȵ�����ˮ�У���ȴ��������кͣ����õ��ij�����( )
A.�Ȼ���
B.��֬������
C.��֬����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������������е�CO2�������ӣ��Դ˿�ѧ������ǣ� ��
A. ���γ����꣬���ɭ�ִ��������
B. ��ʹ�����¶����ߣ������ڻ�����̬ʧ��
C. ��ʹ������������������̼������
D. ��ʹʯ���Ҵ����ܽ⣬�ƻ���Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ����ܼ���������Һ����������Һ����(����)
A.NaOH��Һ
B.ʯ����Һ
C.������Һ
D.Na2CO3��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com