


科目:高中化学 来源: 题型:
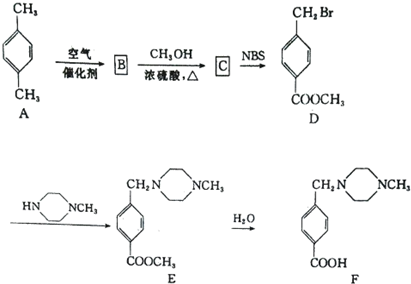
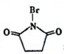 ,则反应C→D的化学方程式为
,则反应C→D的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率关系是:2v正(A)=3v正(D) |
| B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态 |
| C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大 |
| D、达到化学平衡后,升高温度,则C的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
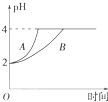 请回答下列问题:
请回答下列问题:| 温度/℃ | 800 | 1 000 | 1 200 | 1 400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1 771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、离子半径的大小顺序为W>Q>Y>Z |
| B、X、Y、W三种元素的电负性大小顺序为X>Y>W |
| C、X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 |
| D、元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | CO2有氧化性 | 点燃的Mg条能在CO2中继续燃烧 |
| B | KNO3的溶解度大 | 可用重结晶法除去KNO3中的NaCl |
| C | Cl2可部分与水反应 | 用排饱和食盐水的法收集Cl2 |
| D | Al3+ 易水解 | 不能用蒸干AlCl3溶液的方法制得AlCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com