
将各0.05 mol的下列物质置于500 mL水中充分搅拌后,溶液中阴离子数目最多的是
A.NH4Br B.K2SO4 C.Mg(OH)2 D.Na2S
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
(1)上述NaOH与HA反应后的溶液中,各离子浓度关系正确的是___________________。
A.c(A-)>c(Na+)>c(H+)>c(OH-) B.c(Na+)>c(A-)>c(OH-)>c(H+)
C.c(A-)>c(OH-)=c(Na+)+c(H+) D.c(Na+)>c(OH-)>c(H+)>c(A-)
(2)试求一元弱酸HA的物质的量浓度_____________________。
(3)盐类水解程度的大小可用“水解度(h)”来表示,对于NaA型盐的水解度(h)为:![]() ×100%。试求上述所得NaA溶液的水解度(h)_________________。
×100%。试求上述所得NaA溶液的水解度(h)_________________。
(4)如果取等物质的量浓度的HA与NaOH按体积比2∶1混合,测得混合溶液的pH>7,则说明HA的电离程度____________NaA的水解程度。(填“大于”“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(带解析) 题型:单选题
将各0.05 mol的下列物质置于500 mL水中充分搅拌后,溶液中阴离子数目最多的是
| A.NH4Br | B.K2SO4 | C.Mg(OH)2 | D.Na2S |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市东城区示范校高三12月教学质量调研化学试卷(解析版) 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
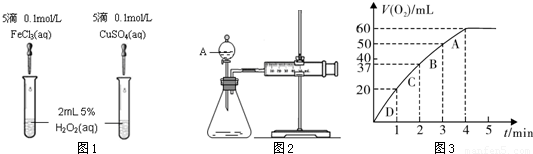
(1)定性分析:如图1可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③A、B、C、D各点反应速率快慢的顺序为: > > > 。
解释反应速率变化的原因 。
④H2O2的初始物质的量浓度是 (请保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com